Các tế bào hồng cầu (red blood cells hay erythrocytes)
Sự sản xuất các tế bào hồng cầu
Erythropoietin kích thích sự sản xuất của tiền nguyên hồng cầu từ các tế bào gốc tạo máu. Khi một động vật hoặc một người được đặt trong một khí quyển ít oxygen, erythropoietin bắt đầu được hình thành trong vòng vài phút đến vài giờ và nó đạt đến sự sản xuất tối đa trong vòng 24 giờ. Tuy nhiên, hầu như không có RBCs mới xuất hiện trong máu tuần hoàn cho đến khoảng 5 ngày sau. Từ đây, cũng như là từ các nghiên cứu khác, người ta đã xác định rằng tác động quan trọng của erythropoietin là kích thích sự sản xuất của các tiền nguyên hồng cầu từ các tế bào gốc tạo máu trong tủy xương. Ngoài ra, một khi các tiền nguyên hồng cầu được hình thành, erythropoietin làm cho các tế bào này đi nhanh qua các giai đoạn nguyên hồng cầu khác nhau hơn so với bình thường, làm tăng tốc nhanh hơn sự sản xuất của các RBCs mới. Sự sản xuất nhanh của các tế bào tiếp tục miễn là người đó vẫn ở trong tình trạng oxygen thấp hay cho đến khi đủ RBCs được sản xuất để mang các lượng oxygen đầy đủ đến các mô mặc cho mức oxygen thấp; vào lúc này, tốc độ sản xuất erythropoietin giảm xuống đến một mức mà sẽ vẫn duy trì số lượng RBCs cần thiết nhưng không dư thừa.
Trong sự vắng mặt của erythropoietin, một ít RBCs được hình thành bởi tủy xương. Ở các tình trạng khắc nghiệt khác, khi các lượng lớn erythropoietin được hình thành, và nếu như nhiều sắt và các chất dinh dưỡng cần thiết khác có sẵn thì tốc độ sản xuất RBC có thể tăng đến có lẽ là 10 lần hoặc nhiều hơn so với bình thường. Vì thế, cơ chế erythropoietin trong kiểm soát sự sản xuất RBC là một cơ chế mạnh mẽ.
Sự trưởng thành của các tế bào hồng cầu cần vitamin B12 (cyanocobalamin) và folic acid
Do nhu cầu liên tục trong việc “làm đầy lại” RBCs, nên các tế bào sinh hồng cầu của tủy xương là trong số những tế bào tăng trưởng và sản sinh nhanh nhất trên toàn bộ cơ thể. Vì thế, như những gì có thể đoán được, sự trưởng thành và tốc độ sản xuất của chúng bị ảnh hưởng đáng kể bởi tình trạng dinh dưỡng của một người.
Đặc biệt quan trọng đối với sự trưởng thành cuối cùng của các RBCs là hai vitamins, vitamin B12 và folic acid. Cả hai vitamin này đều thiết yếu đối với sự tổng hợp DNA bởi vì mỗi vitamin, theo một cách khác nhau, cần cho sự hình thành của thymidine triphosphate, một trong số các thành phần cấu trúc của DNA. Vì thế, thiếu vitamin B12 hay folic acid tạo ra DNA bất thường hoặc suy giảm và kết quả là sự sai sót trong sự trưởng thành của nhân và sự phân chia tế bào. Hơn thế nữa, các tế bào nguyên hồng cầu của tủy xương ngoài việc không thể tăng sinh sinh chóng, chúng còn tạo ra chủ yếu các RBCs lớn hơn so với bình thường được gọi là các đại hồng cầu (macrocytes), mà có một màng mỏng và thường không đều, lớn và có hình bầu dục thay vì hình đĩa lõm hai mặt như bình thường. Các tế bào được hình thành kém này sau khi đi vào trong hệ thống tuần hoàn thì có khả năng mang oxygen một cách bình thường, nhưng tính dễ vỡ của nó làm cho chúng có đời sống ngắn, một nửa hoặc một phần ba so với bình thường. Vì thế, sự thiếu hụt vitamin B12 hay folic acid gây ra sự suy giảm trưởng thành (maturation failure) trong quá trình sinh hồng cầu.
Thiếu máu do suy giảm trưởng thành được gây ra bởi sự hấp thu vitamin B12 kém từ đường tiêu hóa – thiếu máu ác tính. Một nguyên nhân thông thường của quá trình suy giảm sự trưởng thành của RBC là suy giảm hấp thu vitamin B12 từ đường tiêu hóa. Trường hợp này thường xảy ra trong bệnh thiếu máu ác tính (pernicious anemia), trong đó tình trạng bất thường cơ bản là một teo niêm mạc dạ dày (atrophic gastric mucose) mà không tạo ra các sự bài tiết dạ dày bình thường. Các tế bào thành của các tuyến dạ dày bài tiết một glycoprotein được gọi là yếu tố nội (intrinsic factor) mà kết hợp với vitamin B12 trong thức ăn và khiến vitamin B12 sẵn sàng để hấp thu bởi ruột theo cách sau đây:
1. Yếu tố nội liên kết chặt chẽ với vitamin B12. Trong trạng thái liên kết này, vitamin B12 được bảo vệ khỏi sự tiêu hóa bởi các chất tiết của đường tiêu hóa.
2. Vẫn ở trạng thái liên kết, yếu tố nội liên kết với các vị trí thụ cảm thể chuyên biệt trên các màng bờ bàn chải của các tế bào niêm mạc trong hồi tràng.
3. Vitamin B12 sau đó được vận chuyển vào trong máu trong suốt một vài giờ tiếp theo bởi quá trình ẩm bào, mang yếu tố nội và vitamin cùng nhau qua màng.
Vì thế, thiếu yếu tố nội, làm giảm sự có mặt sẵn của vitamin B12 do sự hấp thu vitamin bị lỗi.
Một khi vitamin B12 được hấp thu từ đường tiêu hóa, nó đầu tiên được tích trữ với các lượng lớn trong gan và sau đó được giải phóng chậm khi cần bởi tủy xương. Lượng tối thiểu của vitamin B12 cần mỗi ngày để duy trì sự trưởng thành RBC bình thường là chỉ 1 đến 3 micrograms, và sự tích trữ bình thường trong gan và các mô cơ thể khác là khoảng 1000 lần lượng này. Vì thế, 3 đến 4 năm của sự hấp thu vitamin B12 bị khiếm khuyết thường cần đến để gây ra thiếu máu do rối loạn trưởng thành hồng cầu.
Thiếu máu do rối loạn trưởng thành hồng cầu được gây ra bởi sự thiếu hụt folic acid (pteroylglutamic acid). Folic acid là một thành phần bình thường của rau củ xanh, một số trái cây và thịt (đặc biệt là gan). Tuy nhiên, nó dễ dàng bị phá hủy trong suốt quá trình nấu nướng. Ngoài ra, những người mắc các bất thường hấp thu của đường tiêu hóa như bệnh ruột non thường xảy ra được gọi là “sprue”, thường có sự khó khăn lớn trong hấp thu cả folic acid và vitamin B12. Vì thế, trong nhiều trường hợp suy giảm trưởng thành hồng cầu, nguyên nhân là do suy giảm sự hấp thu của ruột đối với folic acid và vitamin B12.
Sự hình thành hemoglobin
Sự tổng hợp hemoglobin bắt đầu trong các nguyên hồng cầu đa sắc và thậm chí tiếp tục vào trong giai đoạn hồng cầu lưới của RBCs. Vì thế, khi các tế bào hồng cầu lưới rời tủy xương và đi vào trong máu, chúng tiếp tục hình thành nên các lượng nhỏ hemoglobin trong một ngày tiếp theo hay lâu hơn cho đến khi chúng trở thành các tế bào hồng cầu trưởng thành.
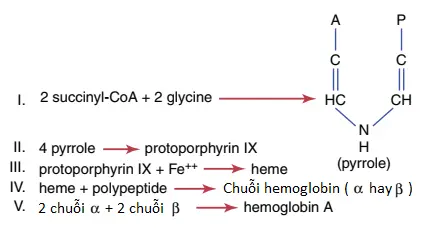
Hình 1 cho thấy các bước hóa học cơ bản trong sự hình thành hemoglobin. Đầu tiên, succinyl-CoA, mà được hình thành trong chu trình chuyển hóa Krebs (như được giải thích trong một loạt bài viết khác), liên kết với glycine để hình thành nên một phân tử pyrrole. Cuối cùng, bốn pyrrole kết hợp lại để hình thành nên protoporphyrin IX, thành phần mà sau đó kết hợp với sắt để hình thành nên phân tử heme. Cuối cùng, mỗi phân tử heme kết hợp với một chuỗi polypeptide dài, một globin được tổng hợp bởi ribosomes, hình thành nên một tiểu đơn vị của hemoglobin được gọi là chuỗi hemoglobin (hemoglobin chain) (Hình 2). Mỗi chuỗi có một trọng lượng phân tử là khoảng 16,000; bốn chuỗi này, cuối cùng, liên kết lỏng lẻo với nhau để hình thành nên phân tử hemoglobin toàn phần.
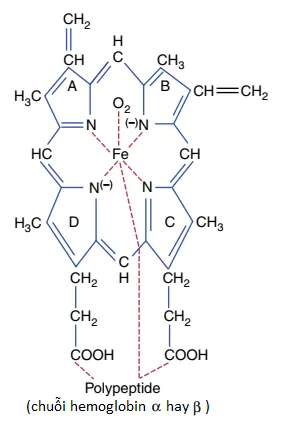
Có một vài biến thể hơi khác nhau trong các chuỗi hemoglobin tiểu đơn vị, phụ thuộc vào thành phần amino acid của phần polypeptide. Các loại khác nhau của các chuỗi được ký hiệu là các chuỗi alpha (α), beta (β), gamma (γ) và delta (δ). Dạng phổ biến nhất của hemoglobin ở người trưởng thành, là hemoglobin A, là sự kết hợp của hai chuỗi alpha và hai chuỗi beta. Hemoglobin A có một trọng lượng phân tử là 64,458.
Bởi vì mỗi chuỗi hemoglobin có một nhóm phụ heme chứa một nguyên tử sắt và bởi vì có bốn chuỗi hemoglobin trong mỗi phân tử hemoglobin nên chúng ta có thể thấy 4 nguyên tử sắt trong mỗi phân tử hemoglobin. Mỗi trong số này có thể liên kết lỏng lẻo với một phân tử oxygen, tạo ra tổng cộng bốn phân tử oxygen (hay 8 nguyên tử oxygen) mà có thể được vận chuyển bởi mỗi phân tử hemoglobin.
Các loại chuỗi hemoglobin trong phân tử hemoglobin xác định ái tính liên kết của hemoglobin đối với oxygen. Các bất thường của các chuỗi có thể làm thay đổi các đặc điểm vật lý của phân tử hemoglobin. Ví dụ, thiếu máu hồng cầu hình liềm (sickle cell anemia), amino acid valine được thay thế cho glutamic acid ở một điểm trong mỗi chuỗi trong số hai chuỗi beta. Khi loại hemoglobin này được tiếp xúc với hàm lượng oxygen thấp thì nó hình thành nên các tình thể dài bên trong các RBCs mà đôi khi dài đến 15 micrometers. Các tinh thể này khiến các tế bào hầu như không thể đi qua các mao mạch nhỏ, và các đầu nhọn của các tinh thể dường như làm phá vỡ các màng tế bào, dẫn đến bệnh thiếu máu hồng cầu hình liềm.
Hemoglobin kết hợp có thể đảo ngược với oxygen. Đặc điểm quan trọng nhất của phân tử hemoglobin là khả năng của nó trong việc kết hợp lỏng lẻo và có thể đảo ngược với oxygen. Khả năng này được bàn đến chi tiết trong loạt bài viết sau trong mối liên hệ với sự hô hấp bởi vì chức năng chủ yếu của hemoglobin trong cơ thể là kết hợp với oxygen trong các phổi và sau đó giải phóng oxygen này một cách dễ dàng trong các mao mạch của mô ngoại vi, nơi mà áp lực khí của oxygen thì thấp hơn nhiều so với trong các phổi.
Oxygen không kết hợp với hai liên kết dương của sắt trong phân tử hemoglobin. Thay vào đó, nó liên kết một cách lỏng lẻo với một trong số các liên kết được gọi là các liên kết phối trí của nguyên tử sắt. Liên kết này thì cực kỳ lỏng lẻo, vì thế, sự kết hợp này thì có thể đảo ngược dễ dàng. Hơn thế nữa, oxygen không trở thành oxygen dạng ion mà nó được mang dưới dạng oxygen phân tử (bao gồm 2 nguyên tử oxygen) đến các mô, nơi mà do sự kết hợp lỏng lẻo, dễ dàng đảo ngược, nên nó được giải phóng vào trong các dịch mô mà vẫn ở dạng oxygen phân tử chứ không phải ở dạng oxygen ion.
Chuyển hóa sắt
Bởi vì sắt thì quan trọng đối với sự hình thành của không chỉ hemoglobin mà còn của các thành phần thiết yếu khác trong cơ thể (như myoglobin, cytochromes, cytochrome oxidase, peroxidase và catalase), nên rất quan trọng để hiểu được con đường mà sắt được sử dụng trong cơ thể. Tổng lượng sắt trong cơ thể trung bình là 4 đến 5 grams, khoảng 65% trong số đó là ở dạng hemoglobin. Khoảng 4% là ở dạng myoglobin, 1% là ở dạng của các hợp chất heme khác mà thúc đẩy sự oxy hóa nội bào, 0.1% là được kết hợp với protein transferrin trong huyết tương và 15% đến 30% là được tích trữ để sử dụng sau, chủ yếu là trong hệ thống võng nội mô và các tế bào nhu mô gan, chủ yếu là ở dạng ferritin.
Sự vận chuyển và sự tích trữ sắt. Sự vận chuyển, sự tích trữ và sự chuyển hóa sắt trong cơ thể được sơ đồ hòa trong Hình 3 và có thể được giải thích như sau. Khi sắt được hấp thu từ ruột non, nó ngay lập tức kết hợp trong huyết tương với một beta globulin, là apotransferrin, để hình thành nên transferrin, mà sau đó được vận chuyển trong huyết tương. Sắt được liên kết lỏng lẻo trong transferrin và, cuối cùng, có thể được giải phóng đến bất cứ tế bào mô nào ở bất cứ vị trí nào trong cơ thể. Lượng sắt quá mức trong máu được lắng đọng đặc biệt trong các tế bào gan và ít hơn trong các tế bào võng nội mô của tủy xương.

Trong bào tương của tế bào, sắt kết hợp chủ yếu với một protein, được gọi là apoferritin, để hình thành nên ferritin. Apoferritin có một trọng lượng phân tử khoảng 460,000 và các lượng sắt khác nhau có thể kết hợp ở dạng các cụm của các gốc sắt với phân tử lớn này; vì thế, ferritin có thể chỉ chứa một lượng nhỏ hoặc một lượng lớn sắt. Sắt được tích trữ dưới dạng ferritin được gọi là sắt tích trữ (storage iron).
Các lượng sắt nhỏ hơn trong “hồ tích trữ” thì ở một dạng cực kì không tan được gọi là hemosiderin. Điều này thì đặc biệt đúng khi tổng lượng sắt trong cơ thể nhiều hơn hồ tích trữ apoferritin có thể chứa. Hemosiderin tích tụ trong các tế bào ở dạng các cụm lớn mà có thể được quan sát thấy dưới kính hiển vi dưới dạng các phần tử lớn. Ngược lại, các phần tử ferritin thì nhỏ và phân tán đến nỗi chúng thường chỉ có thể quan sát được trong bào tương bởi kính hiển vi điện tử.
Khi lượng sắt trong huyết tương giảm xuống thấp thi một ít sắt trong hồ tích trữ ferritin được loại bỏ một cách dễ dàng và được vận chuyển ở dạng transferrin trong huyết tương đến các khu vực của cơ thể, nơi mà nó được cần đến. Một đặc điểm đặc biệt của phân tử transferrin là nó liên kết mạnh mẽ với các thụ cảm thể trong các màng tế bào của các nguyên hồng cầu trong tủy xương. Sau đó, cùng với sắt liên kết của nó, nó được tiêu hóa vào trong các nguyên hồng cầu bởi quá trình nhập bào. Ở đó, transferrin vận chuyển sắt một cách trực tiếp đến ty thể, nơi mà heme được tổng hợp. Ở những người mà không có đủ các lượng transferrin trong máu của họ, suy giảm khả năng vận chuyển sắt đến các nguyên hồng cầu theo cách này có thể gây ra thiếu máu nhược sắt (hypochromic anemia) (nghĩa là các RBCs chứa ít hemoglobin hơn nhiều so với bình thường).
Khi RBCs sống hết thời gian sống của chúng là khoảng 120 ngày và bị phá hủy, hemoglobin được giải phóng tử các tế bào được tiêu hóa bởi các tế bào bạch cầu mono-đại thực bào. Ở đó, sắt được giải phóng và được tích trữ chủ yếu trong hồ ferritin để được sử dụng khi cần cho sự hình thành của hemoglobin mới.
Sự mất sắt hằng ngày. Một người nam giới trung bình bài tiết khoảng 0.6 mg sắt mỗi ngày, chủ yếu là vào trong phân. Các lượng sắt thêm bị mất đi khi chảy máu xảy ra. Đối với một nữ giới, sự mất máu thêm do chu kỳ kinh nguyệt làm cho sự mất sắt dài hạn lên đến một trung bình là khoảng 1.3 mg/ngày.
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!