Sự tự điều hòa của mức lọc cầu thận và lưu lượng máu thận
Các cơ chế phản hồi nội tại của các thận bình thường giữ cho lưu lượng máu thận và GFR tương đối hằng định mặc cho các sự thay đổi đáng kể trong áp suất động mạch. Các cơ chế này vẫn thực hiện chức năng trong các thận được tưới máu mà đã loại bỏ khỏi cơ thể, độc lập với các tác động hệ thống. Tính hằng định tương đối này của GFR và lưu lượng máu thận được gọi là sự tự điều hòa (autoregulation) (Hình 1).

Chức năng chủ yếu của sự tự điều hòa lưu lượng máu trong hầu hết các mô, khác ngoài thận, là duy trì sự vận chuyển oxygen và các chất dinh dưỡng ở một mức bình thường và loại bỏ các sản phẩm thải của quá trình chuyển hóa, mặc cho các sự thay đổi trong áp suất động mạch. Trong các thận, lưu lượng máu bình thường thì cao hơn nhiều so với mức cần cho các chức năng này. Chức năng chính của sự tự điều hòa trong các thận là để duy trì một GFR tương đối hằng định và cho phép sự kiểm soát chính xác của sự bài tiết nước và các chất tan bởi các thận.
GFR bình thường vẫn tương đối hằng định, mặc cho các sự dao động áp suất động mạch đáng kể mà xảy ra trong suốt các hoạt động thường ngày của một người. Ví dụ, một sự giảm trong áp suất động mạch xuống đến 70 đến 75 mm Hg hoặc một sự tăng lên cao đến 160 đến 180 mm Hg thường làm thay đổi GFR dưới 10%. Nhìn chung, lưu lượng máu thận được tự điều hòa cùng với GFR, nhưng GFR được tự điều hòa một cách hiệu quả hơn dưới một số điều kiện.
Tầm quan trọng của sự tự điều hòa mức lọc cầu thận trong ngăn cản các sự thay đổi quá mức trong sự bài tiết của thận
Mặc dù các cơ chế tự điều hòa của thận thì không hoàn hảo nhưng chúng giúp ngăn cản các sự thay đổi lớn tiềm tàng trong GFR và sự bài tiết nước và các chất tan của thận mà nếu không được thực hiện thì sẽ gây ra các sự thay đổi trong huyết áp. Chúng ta có thể hiểu tầm quan trọng định lượng của sự tự điều hòa bằng cách xem xét các mức tương ứng của sự lọc cầu thận, sự tái hấp thu ống thận và sự bài tiết của thận và các thay đổi trong sự bài tiết của thận mà sẽ xảy ra nếu không có các cơ chế tự điều hòa.
Bình thường, GFR là khoảng 180 L/ngày và sự tái hấp thu ống thận là 178.5 L/ngày, còn lại 1.5 L/ngày dịch là được bài tiết trong nước tiểu. Trong sự vắng mặt của cơ chế tự điều hòa, một sự tăng lên tương đối nhỏ trong huyết áp (từ 100 đến 125 mm Hg) sẽ gây ra một sự tăng lên tương đương 25% trong GFR (từ khoảng 180 đến 225 L/ngày). Nếu như sự tái hấp thu ống thận vẫn hằng định ở 178.5 L/ngày thì lưu lượng nước tiểu sẽ tăng đến 46.5 L/ngày (sự chênh lệch giữa GFR và sự tái hấp thu ống thận) – một sự tăng lên tổng cộng trong thể tích nước tiểu hơn 30 lần. Bởi vì tổng thể tích huyết tương thì chỉ khoảng 3 lít nên một sự thay đổi như vậy sẽ nhanh chóng làm cạn kiệt thể tích máu.
Trong thực tế, các sự thay đổi trong áp suất động mạch thường tạo ra một tác động ít hơn nhiều lên thể tích nước tiểu vì hai lý do: (1) sự tự điều hòa của thận ngăn cản các sự thay đổi lớn trong GFR mà đáng lẽ sẽ xảy ra; và (2) có các cơ chế thích nghi bổ sung trong các ống thận mà làm cho chúng tăng mức tái hấp thu khi GFR tăng lên, một hiện tượng được gọi là thăng bằng cầu thận – ống thận (glomerulotubular balance) (sẽ được nói đến trong loạt bài viết tiếp theo). Ngay cả với các cơ chế kiểm soát đặc biệt này, các sự thay đổi trong áp suất động mạch vẫn có các tác động đáng kể lên sự bài tiết của thận đối với nước và natri; tác động này được gọi là lợi niệu áp suất (pressure diuresis) hay lợi niệu natri áp suất (pressure natriuresis) và là cần thiết trong sự điều hòa các thể tích dịch cơ thể và áp suất động mạch.
Phản hồi ống thận-cầu thận và sự tự điều hòa của mức lọc cầu thận
Các thận có một cơ chế phản hồi đặc biệt mà liên hệ giữa các sự thay đổi trong nồng độ natri chloride ở vết đặc với sự kiểm soát sức cản tiểu động của thận và sự tự điều hòa của GFR. Sự phản hồi này giúp đảm bảo một sự vận chuyển tương đối hằng định của natri chloride đến ống lượn xa và giúp ngăn cản các sự dao động giả trong sự bài tiết của thận mà nếu không nó sẽ xảy ra. Trong nhiều trường hợp, sự phản hồi này tự điều hòa lưu lượng máu thận và GFR cùng lúc. Tuy nhiên, bởi vì cơ chế này thì được điều hướng một cách đặc hiệu đến việc làm ổn định sự vận chuyển natri chloride đến ống lượn xa nên các trường hợp mà xảy ra khi GFR được tự điều hòa là do các sự thay đổi trong lưu lượng máu thận, sẽ được nói đến sau. Trong các trường hợp khác, cơ chế này có thể thực sự gây ra các sự thay đổi trong GFR trong đáp ứng với các sự thay đổi chủ yếu trong sự tái hấp thu natri chloride của ống thận.
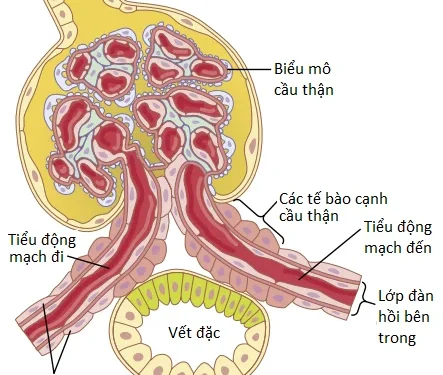
Cơ chế phản hồi ống thận-cầu thận có hai thành phần mà đóng vai trò cùng với nhau để kiểm soát GFR: (1) một cơ chế phản hồi của tiểu động mạch đến; và (2) một cơ chế phản hồi của tiểu động mạch đi. Các cơ chế phản hồi này phụ thuộc vào các sự sắp xếp về mặt giải phẫu đặc trưng của phức hợp cạnh cầu thận (juxtaglomerular complex) (Hình 2).

Phức hợp cạnh cầu thận bao gồm các tế bào vết đặc (macula densa cells) trong phần đầu của ống lượn xa và các tế bào cạnh cầu thận (juxtaglomerular cells) trong các thành của các tiểu động mạch đến và đi. Vết đặc là một nhóm tế bào biểu mô chuyên biệt trong ống lượn xa mà có liên quan gần với các tiểu động mạch đến và đi. Các tế bào vết đặc chứa bộ máy Golgi, là thành phần bao gồm các hạt bào quan bài tiết nội bào hướng về phía các tiểu động mạch, cho thấy rằng các tế bào này có thể đang tiết một chất về phía các tiểu động mạch.
Giảm natri chloride ở vết đặc gây ra sự giãn của các tiểu động mạch đến và tăng sự bài tiết renin. Các tế bào vết đặc cảm nhận các sự thay đổi trong sự vận chuyển natri chloride đến ống lượn xa bởi đường các tín hiệu mà không được hiểu một cách hoàn toàn. Các nghiên cứu thực nghiệm đã cho thấy rằng một GFR giảm làm chậm tốc độ dịch chảy trong quai Henle, gây ra sự tái hấp thu tăng lên trong phần trăm natri và chloride được vận chuyển đến nhánh lên của quai Henle và bằng cách đó, làm giảm nồng độ natri chloride ở các tế bào vết đặc. Sự giảm này trong nồng độ natri chloride khởi động cho một tín hiệu từ vết đặc mà có hai tác động (Hình 3): (1) nó làm giảm sức cản đối với dòng máu trong các tiểu động mạch đến, điều mà làm tăng áp suất thủy tĩnh của cầu thận và giúp đưa GFR về mức bình thường ; và (2) nó làm tăng sự giải phóng renin từ các tế bào cạnh cầu thận của các tiểu động mạch đến và đi, là các vị trí tích trữ chính cho renin. Renin được giải phóng từ các tế bào này sau đó thực hiện chức năng như là một enzyme mà làm tăng sự hình thành của angiotensin I, chất mà được chuyển thành angiotensin II. Cuối cùng, angiotensin II làm co các tiểu động mạch đi, bằng cách đó làm tăng áp suất thủy tĩnh cầu thận và giúp đưa GFR về giá trị bình thường.
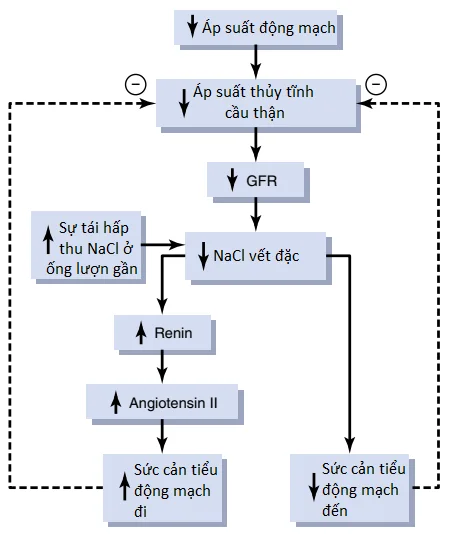
Hai thành phần của cơ chế phản hồi ống thận – cầu thận này, vận hành cùng với nhau bởi cấu trúc giải phẫu chuyên biệt của phức hợp cạnh cầu thận, cung cấp các tín hiệu phản hồi đến các tiểu động mạch đến và đi cho sự tự điều hòa hiệu quả của GFR trong suốt các sự thay đổi trong áp suất động mạch. Khi cả hai cơ chế này thực hiện chức năng cùng với nhau, các sự thay đổi trong GFR chỉ khoảng một vài phần trăm, ngay cả với các sự biến động lớn trong áp suất động mạch giữa các giới hạn là 75 và 160 mm Hg.
Ngăn chặn sự hình thành angiotensin II làm giảm mức lọc cầu thận nhiều hơn nữa trong suốt quá trình giảm tưới máu thận. Như được bàn đến trước đây, một hoạt động co ưu tiên của angiotensin II trên các tiểu động mạch đi giúp ngăn cản các sự giảm nghiêm trọng trong áp suất thủy tĩnh cầu thận và GFR khi áp suất tưới máu thận giảm xuống dưới mức bình thường. Sự sử dụng các thuốc mà chặn sự hình thành của angiotensin II (các thuốc ức chế men chuyển) hoặc các thuốc mà chặn hoạt động của angiotensin II (các thuốc đối kháng thụ cảm thể angiotensin II) có thể gây ra các sự giảm mạnh trong GFR hơn bình thường khi áp suất động động mạch giảm dưới mức bình thường. Vì thế, một biến chứng quan trọng khi sử dụng các thuốc này để điều trị cho các bệnh nhân mắc tăng huyết áp do hẹp động mạch thận (tắc nghẽn một phần của động mạch thận) là một sự giảm nghiêm trọng trong GFR mà có thể, trong một số trường hợp, gây ra suy thận cấp. Bất kể là như vậy, các thuốc chặn angiotensin II là các thuốc điều trị quan trọng ở nhiều bệnh nhân mắc tăng huyết áp, suy tim sung huyết và các tình trạng bệnh khác, miễn là các bệnh nhân được theo dõi để đảm bảo rằng các sự giảm nặng trong GFR không xảy ra.
Sự tự điều hòa do cơ trong lưu lượng máu thận và mức lọc cầu thận
Một cơ chế khác mà đóng góp vào sự duy trì của một lưu lượng máu thận và GFR tương đối hằng định là khả năng của các mạch máu riêng biệt trong việc kháng lại sức căng trong suốt quá trình áp suất động mạch tăng lên, được gọi là cơ chế do cơ (myogenic mechanism). Các nghiên cứu về các mạch máu riêng biệt (đặc biệt là các tiểu động mạch nhỏ) trên khắp cơ thể đã cho thấy rằng chúng đáp ứng với sức căng thành tăng lên bởi sự co của cơ trơn mạch máu. Sự căng ra của thành mạch máu cho phép sự chuyển động tăng lên của các ion canxi từ dịch ngoại bào vào trong các tế bào, làm cho chúng co thông qua các cơ chế sẽ được bàn đến trong các bài viết sau này nhé (chương 8 mình chưa dịch :)))). Sự co này ngăn cản sự căng quá mức của mạch máu và cùng lúc đó, bằng cách làm tăng sức cản mạch máu, giúp ngăn cản các sự tăng lên quá mức trong lưu lượng máu thận và GFR khi áp suất động mạch tăng lên.
Mặc dù cơ chế do cơ dường như được thực hiện trong hầu hết các tiểu động mạch trên khắp cơ thể, nhưng tầm quan trọng của nó trong sự tự điều hòa lưu lượng máu thận và GFR đã bị nghi ngờ bởi một số nhà sinh lý học bởi vì cơ chế nhạy cảm áp suất này không có cách nào để phát hiện các sự thay đổi trong lưu lượng máu thận hay GFR một cách trực tiếp. Mặt khác, cơ chế này có lẽ quan trọng hơn trong việc bảo vệ thận khỏi tổn thương do tăng huyết áp. Trong đáp ứng với các sự tăng lên đột ngột trong huyết áp, đáp ứng co do cơ trong các tiểu động mạch đến xảy ra trong vòng vài giây và vì thế làm giảm nhẹ sự lan truyền áp suất động mạch tăng lên đến các mao mạch cầu thận.
Ăn vào nhiều protein và tăng đường huyết sẽ làm tăng lưu lượng máu thận và mức lọc cầu thận. Mặc dù lưu lượng máu thận và GFR thì tương đối ổn định dưới hầu hết các điều kiện, nhưng vẫn có các trường hợp mà các biến số này thay đổi một cách đáng kể. Ví dụ, một sự ăn vào nhiều protein được biết là làm tăng lưu lượng máu thận và GFR. Trong một khoảng thời gian dài, chế độ ăn giàu protein, như một bữa ăn mà chứa các lượng lớn thịt, sẽ làm tăng GFR và lưu lượng máu thận một phần là do sự tăng trưởng của các thận. Tuy nhiên, GFR và lưu lượng máu thận cũng tăng 20% đến 30% trong vòng 1 hoặc 2 giờ sau khi một người ăn một bữa ăn giàu protein.
Một sự giải thích có khả năng cho GFR tăng lên là như sau. Một bữa ăn giàu protein giúp giải phóng vào trong máu các amino acids, là thành phần được tái hấp thu trong ống lượn gần. Bởi vì các amino acids và natri được tái hấp thu cùng với nhau bởi sự đồng vận chuyển (cotransport) trong ống lượn gần, nên tăng sự tái hấp thu amino acid cũng kích thích sự tái hấp thu natri. Sự tăng tái hấp thu natri này làm giảm sự vận chuyển natri đến vết đặc (xem Hình 4), là yếu tố kích thích một sự giảm trong sức cản của các tiểu động mạch đến qua trung gian phản hồi ống thận – cầu thận, như đã được nói đến trước đây. Sức cản của tiểu động mạch đến giảm sau đó sẽ làm tăng lưu lượng máu thận và GFR, cho phép sự bài tiết natri được suy trì ở một mức gần bình thường đồng thời làm tăng sự bài tiết của các sản phẩm thải của chuyển hóa protein như urea.

Một cơ chế tương tự cũng có thể giải thích cho các sự tăng lên đáng kể trong lưu lượng máu thận và GFR mà xảy ra với các sự tăng lên nhiều trong glucose máu ở những người mắc đái tháo đường không kiểm soát. Bởi vì glucose, giống như một số các amino acids, được tái hấp thu cùng với natri trong ống lượn gần, tăng vận chuyển glucose đến các ống thận làm cho chúng tái hấp thu quá mức natri cùng với glucose. Sư tăng tái hấp thu này của natri cuối cùng sẽ làm giảm nồng độ natri chloride ở vết đặc, làm hoạt hóa sự giãn các tiểu động mạch đến qua trung gian phản hồi ống thận – cầu thận và các sự tăng lên kế tiếp trong lưu lượng máu thận và GFR.
Các ví dụ này cho thấy rằng chính lưu lượng máu thận và GFR thì không phải là các biến số chủ yếu được kiểm soát bởi cơ chế phản hồi ống thận – cầu thận. Mục đích chính của cơ chế phản hồi này là đảm bảo một sự vận chuyển natri chloride hằng định đến ống lượn xa, nơi mà sự xử lý cuối cùng của nước tiểu diễn ra. Vì thế, các rối loạn mà có khuynh hướng làm tăng sự tái hấp thu của natri chloride ở các vị trí ống thận trước vết đặc có khuynh hướng kích thích lưu lượng máu thận và GFR tăng lên, điều mà giúp đưa sự vận chuyển natri chloride đến ống lượn xa về mức bình thường sao cho các mức bài tiết natri và nước bình thường có thể được duy trì (xem Hình 4).
Một kết quả ngược lại của các sự kiện xảy ra khi sự tái hấp thu của ống lượn gần giảm xuống. Ví dụ, khi các ống lượn gần bị tổn thương (điều mà có thể xảy ra như là kết quả của ngộ độc kim loại nặng như thủy ngân hoặc các liều lớn thuốc như tetracyclines), khả năng tái hấp thu natri chloride của chúng bị giảm. Kết quả, các lượng lớn natri chloride được vận chuyển đến ống lượn xa và, nếu không có sự đền bù thích hợp sẽ nhanh chóng gây ra sự giảm thể tích quá mức. Một trong số các đáp ứng đền bù quan trọng là một sự co mạch thận qua trung gian phản hồi ống thận – cầu thận mà xảy ra trong đáp ứng với việc tăng vận chuyển natri chloride đến vết đặc trong các trường hợp này. Các ví dụ này một lần nữa cho thấy tầm quan trọng của cơ chế phản hồi này trong việc đảm bảo rằng các ống lượn xa nhận các mức vận chuyển natri chloride, các chất tan trong dịch ống thận khác và thể tích dịch ống thận thích hợp, sao cho các lượng thích hợp của các chất này được bài tiết trong nước tiểu.
Các yếu tố khác mà ảnh hưởng đến lưu lượng máu thận và mức lọc cầu thận. GFR và lưu lượng máu thận thì thấp lúc mới sinh, tiệm cận các mức ở người trưởng thành bình thường sau khoảng 2 năm cuộc đời, và khi không mắc bệnh thận, thì được duy trì tương đối hằng định cho đến năm 40 tuổi. Sau đó, GFR giảm khoảng 5% đến 10% mỗi thập kỷ mặc dù có sự thay đổi đáng kể giữa những người khác nhau. Sự giảm này trong GFR trùng hợp với sự giảm trong nitric oxide, tăng stress oxy hóa và mất các nephrons chức năng, các tình trạng mà có thể liên quan một phần với huyết áp tăng lên, các rối loạn chuyển hóa và các chấn thương khác mà gây ra tổn thương cầu thận tích lũy theo tuổi.
Nam giới có lưu lượng máu thận và GFR cao hơn so với nữ giới, ngay cả khi đã hiệu chỉnh đối với khối lượng cơ thể. Tuy nhiên, nam giới cũng có một sự suy giảm trong GFR nhanh hơn theo tuổi so với nữ giới trước mãn kinh. Mặc dù các cơ chế chịu trách nhiệm cho các sự khác biệt giới tính này thì không hoàn toàn được hiểu rõ nhưng các tác động có lợi của estrogen và các tác động gây tổn thương của androgen lên các thận được cho là sự giải thích một phần. Bảng 1 tóm tắt thêm một số yếu tố mà ảnh hưởng đến sự điều hòa lưu lượng máu thận và GFR và nên được cân nhắc khi đánh giá chức năng thận.

Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!