Sự điều hòa thăng bằng ion hydrogen (H+) thì tương tự trên một số phương diện so với sự điều hòa của các ion khác trong cơ thể. Ví dụ, phải có một sự thăng bằng giữa lượng ăn vào hay sự sản xuất H+ và sự loại bỏ toàn phần của H+ khỏi cơ thể để đạt được cân bằng nội môi. Và, như cũng đúng đối với các ion khác, các thận đóng một vai trò quan trọng trong điều hòa sự loại bỏ H+ khỏi cơ thể. Tuy nhiên, sự kiểm soát chính xác của nồng độ H+ trong dịch ngoại bào liên quan đến nhiều vấn đề hơn nhiều so với việc đơn giản là loại bỏ H+ bởi các thận. Nhiều cơ chế đệm acid-base liên quan đến máu, các tế bào và các phổi cũng cần thiết để duy trì các nồng độ H+ bình thường trong các dịch ngoại bào và nội bào.
Trong loạt bài viết này, chúng ta sẽ xem xét các cơ chế mà điều hòa nồng độ H+, với sự nhấn mạnh đặc biệt lên sự bài tiết H+ của thận và sự tái hấp thu, sự sản xuất và sự bài tiết ion bicarbonate (HCO3–) của thận, một trong số các thành phần quan trọng của các hệ thống kiểm soát acid-base trong các dịch cơ thể.
Nồng độ ion hydrogen được điều hòa một cách chính xác
Sự điều hòa H+ chính xác thì thiết yếu bởi vì các hoạt động của hầu hết tất cả các hệ thống enzyme trong cơ thể bị ảnh hưởng bởi nồng độ H+. Vì thế, các sự thay đổi trong nồng độ H+ làm thay đổi hầu như tất cả các chức năng tế bào và cơ thể.
So với các ion khác, nồng độ H+ của các dịch cơ thể bình thường được giữ ở một mức thấp. Ví dụ, nồng độ natri trong dịch ngoại bào (142 mEq/L) lớn hơn khoảng 3.5 triệu lần so với nồng độ H+ bình thường mà trung bình có giá trị chỉ khoảng 0.00004 mEq/L. Ngoài ra, sự thay đổi bình thường trong nồng độ H+ trong dịch ngoại bào là chỉ khoảng một phần triệu so với sự thay đổi bình thường trong nồng độ ion natri (Na+). Vì thế, độ chính xác mà H+ được điều hòa nhấn mạnh tầm quan trọng của nó đối với các chức năng tế bào khác nhau.
Acids và bases – các định nghĩa và các ý nghĩa
Một ion hydrogen là một proton tự do đơn được giải phóng từ một nguyên tử hydrogen. Các phân tử chứa các nguyên tử hydrogen mà có thể giải phóng các ion hydrogen trong một dung dịch được xem là acids. Một ví dụ là hydrochloric acid (HCl), là chất mà ion hóa trong nước để hình thành nên các ion hydrogen (H+) và ion chloride (Cl–). Tương tự, carbonic acid (H2CO3) ion hóa trong nước để hình thành nên ion H+ và ion bicarbonate (HCO3–).
Một base là một ion hoặc một phân tử mà có thể nhận H+. Ví dụ, HCO3– là một base bởi vì nó có thể kết hợp với H+ để hình thành nên H2CO3. Tương tự, HPO4= là một base bởi vì nó có thể nhận một H+ để hình thành nên H2PO4–. Các proteins trong cơ thể cũng thực hiện chức năng như là các bases bởi vì một số amino acids mà hình thành nên proteins có các tích điện âm toàn phần mà dễ dàng nhận H+. Protein hemoglobin trong các tế bào hồng cầu và proteins trong các tế bào khác của cơ thể là nhiều trong số các bases quan trọng nhất của cơ thể.
Các thuật ngữ “base” và “alkali” thường được sử dụng đồng nghĩa với nhau. Một “alkali” là một phân tử được hình thành bởi sự kết hợp của một hoặc nhiều kim loại kiềm – như natri, kali và lithium – với một ion có tính kiềm cao như một ion hydroxyl (OH–). Phần base của các phân tử này phản ứng nhanh với H+ để loại bỏ nó khỏi dung dịch và vì thế, chúng là các bases điển hình. Vì các lý do tương tự, thuật ngữ “nhiễm kiềm” (alkalosis) đề cập đến sự loại bỏ H+ quá mức khỏi các dịch cơ thể, ngược lại với sự bổ sung quá mức H+ mà được gọi là “nhiễm toan” (acidosis).
Các acids và các bases mạnh và yếu. Một acid mạnh, như HCl, nhanh chóng phân ly và giải phóng đặc biệt nhiều lượng H+ trong dung dịch. Các acids yếu như H2CO3 thì ít có khả năng phân ly các ion của chúng và vì thế, giải phóng H+ ít mạnh mẽ hơn. Một base mạnh là một base mà phản ứng nhanh và mạnh với H+ và vì thế, nhanh chóng loại bỏ H+ khỏi dung dịch. Một ví dụ điển hình là OH–, mà phản ứng với H+ để hình thành nên nước (H2O). Một base yếu điển hình là HCO3– bởi vì nó liên kết với H+ yếu hơn nhiều so với OH–. Hầu hết các acids và bases trong dịch ngoại bào mà liên quan trong sự điều hòa acid-base bình thường là các acids và bases yếu. Các acids và bases yếu quan trọng nhất mà chúng ta sẽ nói đến là acid carbonic acid (H2CO3) và base HCO3–.
Nồng độ H+ và pH bình thường của các dịch cơ thể và các sự thay đổi mà xảy ra trong tình trạng nhiễm toan và nhiễm kiềm. Nồng độ H+ máu bình thường được duy trì với một khoảng giới hạn hẹp quanh một giá trị bình thường là khoảng 0.00004 mEq/L (40 nEq/L). Các thay đổi bình thường chỉ khoảng 3 đến 5 nEq/L nhưng, dưới các điều kiện khắc nghiệt, nồng độ H+ có thể thay đổi từ thấp đến 10 nEq/L đến cao đến 160 nEq/L mà không gây ra tử vong.
Bởi vì nồng độ H+ bình thường thì thấp và bởi vì các con số nhỏ này thì “cồng kềnh” nên thông thường người ta sẽ biểu diễn nồng độ H+ trên một thang đo logarith sử dụng các đơn vị pH. pH thì liên quan với nồng độ H+ thực sự bởi phương trình sau (nồng độ H+ [H+] được biểu diễn ở đơn vị đương lượng (equivalents) mỗi lít):
pH = log(1/[H+]) = -log [H+]
Ví dụ, [H+] bình thường là 40 nEq/L (0.00000004 Eq/L). Vì thế, pH bình thường là như sau:
pH = -log[0.00000004]
pH = 7.4
Từ phương trình này, chúng ta có thể thấy rằng pH tỷ lệ nghịch với nồng độ H+; vì thế, một pH thấp tương ứng với một nồng độ H+ cao và một pH cao tương ứng với một nồng độ H+ thấp.
pH bình thường của máu động mạch là 7.4, ngược lại, pH của máu tĩnh mạch và dịch kẽ là khoảng 7.35 do các lượng carbon dioxide (CO2) thêm vào được giải phóng từ các mô để hình thành nên H2CO3 trong các dịch này (Bảng 1). Bởi vì pH bình thường của máu động mạch là 7.4 nên một người được xem là nhiễm toan máu (acidemia) khi pH giảm đáng kể bên dưới giá trị này và nhiễm kiềm máu (alkalemia) khi pH tăng trên 7.4. Giới hạn dưới của pH mà ở đó một người có thể sống sót hơn một vài giờ là khoảng 6.8 và giới hạn trên là khoảng 8.0.

pH nội bào thường hơi thấp hơn pH huyết tương bởi vì chuyển hóa tế bào sản xuất ra acid, đặc biệt là H2CO3. Phụ thuộc vào loại tế bào, pH của dịch nội bào được ước tính thay đổi giữa 6.0 và 7.4. Hạ oxygen các mô và lưu lượng máu kém đến các mô có thể gây ra sự tích tụ acid và làm giảm pH nội bào. Các thuật ngữ “nhiễm toan” (acidosis) và “nhiễm kiềm” (alkalosis) lần lượt mô tả các quá trình mà dẫn dẫn đến nhiễm toan máu (acidemia) và nhiễm kiềm máu (alkalemia).
pH của nước tiểu có thể thay đổi từ 4.5 đến 8.0, phụ thuộc vào tình trạng acid-base của dịch ngoại bào. Như được bàn luận đến sau, các thận đóng một vai trò quan trọng trong việc chỉnh sửa các bất thường của nồng độ H+ dịch ngoại bào bằng cách bài tiết acids hoặc bases ở các mức độ khác nhau.
Một ví dụ tuyệt vời về một dịch cơ thể có tính acid là HCl mà được bài tiết vào trong dạ dày bởi các tế bào thành (parietal cells hay oxyntic cells) của niêm mạc dạ dày, như được nói đến trong một loạt bài viết tiếp theo. Nồng độ H+ trong các tế bào này là khoảng 4 triệu lần lớn hơn so với nồng độ hydrogen trong máu, với một pH là 0.8. Trong phần còn lại của loạt bài viết này, chúng ta sẽ bàn luận đến sự điều hòa nồng độ H+ của dịch ngoại bào.
Chống lại các sự thay đổi trong nồng độ H+: các hệ đệm, các phổi và các thận
Ba hệ thống chính điều hòa nồng độ H+ trong các dịch cơ thể: (1) các hệ thống đệm acid-base hóa học của các dịch cơ thể, mà ngay lập tức kết hợp với một acid hoặc một base để ngăn cản các sự thay đổi quá mức trong nồng độ H+; (2) trung tâm hô hấp, mà điều hòa sự loại bỏ CO2 (và vì thế, loại bỏ H2CO3) khỏi dịch ngoại bào; và (3) các thận, mà có thể bài tiết nước tiểu có tính acid hoặc có tính kiềm, bằng cách đó, tái điều chỉnh nồng độ H+ dịch ngoại bào về mức bình thường trong suốt quá trình nhiễm toan hay nhiễm kiềm.
Khi có một sự thay đổi trong nồng độ H+ thì các hệ thống đệm (buffer systems) của dịch cơ thể phản ứng trong vòng vài giây để làm giảm thiểu các sự thay đổi này. Các hệ thống đệm không loại bỏ H+ khỏi hay thêm H+ vào trong cơ thể mà chỉ giữ chúng cho đến khi cân bằng có thể được tái thiết lập.
“Lớp phòng thủ thứ hai”, hệ thống hô hấp, đóng vai trò trong vòng một vài phút để loại bỏ CO2 và vì thế, loại bỏ H2CO3 khỏi cơ thể.
Hai “lớp phòng thủ đầu tiên” này giúp giữ nồng độ H+ không bị thay đổi quá nhiều cho đến khi “lớp phòng thủ thứ ba” đáp ứng chậm hơn, là các thận, có thể loại bỏ acid hoặc base dư khỏi cơ thể. Mặc dù các thận thì tương đối chậm trong đáp ứng so với các lớp phòng thủ khác, trong một khoảng thời gian vài giờ đến vài ngày, nhưng chúng là các hệ thống điều hòa acid-base mạnh mẽ hơn rất nhiều.
Đệm H+ trong các dịch cơ thể
Một chất đệm là bất cứ chất nào mà có thể liên kết có thể đảo ngược với H+. Dạng tổng quát của phản ứng đệm là như sau:

Trong ví dụ này, một H+ tự do kết hợp với chất đệm để hình thành nên một acid yếu (H buffer) mà có thể vẫn ở dạng một phân tử không liên kết hoặc phân li ngược trở lại thành chất đệm (buffer) và H+. Khi nồng độ H+ tăng lên, phản ứng được chuyển dịch sang bên phải, và nhiều H+ hơn liên kết với chất đệm, miễn là chất đệm có sẵn. Ngược lại, khi nồng độ H+ giảm xuống, phản ứng dịch chuyển về phía bên trái, và H+ được giải phóng khỏi chất đệm. Theo cách này, các sự thay đổi trong nồng độ H+ được giảm thiểu.
Tầm quan trọng của các chất đệm trong dịch cơ thể có thể nhanh chóng được nhận ra nếu chúng ta để ý nồng độ thấp của H+ trong các dịch cơ thể và các lượng tương đối lớn acids được sản xuất bởi cơ thể mỗi ngày. Khoảng 80 milliequivalents (milli đương lượng) H+ được tiêu hóa hoặc được sản xuất mỗi ngày bởi chuyển hóa, ngược lại, nồng độ H+ của các dịch cơ thể bình thường chỉ khoảng 0.00004 mEq/L. Nếu như không có sự đệm, sự sản xuất và tiêu hóa mỗi ngày của các acids sẽ gây ra các sự thay đổi chết người trong nồng độ H+ dịch cơ thể.
Hoạt động của các chất đệm acid-base có thể có lẽ được giải thích tốt nhất bằng cách xem xét hệ thống đệm mà quan trọng nhất về mặt định lượng trong dịch ngoại bào – hệ thống đệm bicarbonate.
Hệ thống đệm bicarbonate
Hệ thống đệm bicarbonate (bicarbonate buffer system) bao gồm một dung dịch nước mà chứa hai thành phần: (1) một acid yếu, H2CO3 và (2) một muối bicarbonate, như natri bicarbonate (NaHCO3).
H2CO3 được hình thành trong cơ thể bởi phản ứng của CO2 với H2O:
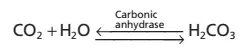
Phản ứng này thì chậm, và các lượng cực kì nhỏ H2CO3 được hình thành nếu như không có mặt enzyme carbonic anhydrase. Enzyme này thì đặc biệt dồi dào trong các thành của các phế nang phổi, nơi mà CO2 được giải phóng; carbonic anhydrase cũng xuất hiện trong các tế bào biểu mô của các ống thận, nơi mà CO2 phản ứng với H2O để hình thành nên H2CO3.
H2CO3 ion hóa yếu để hình thành nên các lượng nhỏ H+ và HCO3–:

Thành phần thứ hai của hệ thống, muối bicarbonate, xuất hiện chủ yếu dưới dạng NaHCO3 trong dịch ngoại bào. NaHCO3 ion hóa gần như hoàn toàn để hình thành nên HCO3– và Na+, như sau:

Bây giờ, đặt toàn bộ hệ thống cùng với nhau, chúng ta có được điều sau đây:
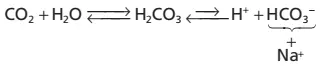
Do sự phân li yếu của H2CO3, nên nồng độ H+ thì cực kì thấp.
Khi một acid mạnh như HCl được thêm vào dung dịch đệm bicarbonate thì H+ tăng lên được giải phóng từ acid (HCl → H+ + Cl−) được đệm bởi HCO3–:
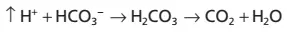
Kết quả, nhiều H2CO3 hơn được hình thành, gây ra sự sản xuất CO2 và H2O tăng lên. Từ các phản ứng này, một điều có thể thấy là H+ từ acid mạnh HCl phản ứng với HCO3– để hình thành nên acid rất yếu H2CO3, chất mà cuối cùng hình thành nên CO2 và H2O. CO2 quá mức kích thích đáng kể sự hô hấp, điều mà giúp loại bỏ CO2 khỏi dịch ngoại bào.
Các phản ứng đối nghịch diễn ra khi một base mạnh như natri hydroxide (NaOH), được thêm vào trong dung dịch đệm bicarbonate.

Trong trường hợp này, OH– từ NaOH kết hợp với H2CO3 để hình thành nên thêm HCO3–. Vì thế, base yếu NaHCO3 sẽ thay thế base mạnh NaOH. Cùng lúc đó, nồng độ của H2CO3 giảm (bởi vì nó phản ứng với NaOH), làm cho nhiều CO2 hơn kết hợp với H2O để thay thế H2CO3:

Vì thế, kết quả cuối cùng, là một khuynh hướng đối với các mức CO2 trong máu giảm, nhưng CO2 giảm trong máu làm ức chế sự hô hấp và làm giảm mức CO2 thở ra. Sự tăng lên trong nồng độ HCO3– xảy ra được đền bù bởi tăng sự bài tiết HCO3– của thận.
Động lực học định lượng của hệ thống đệm bicarbonate
Tất cả các acids, bao gồm cả H2CO3, được ion hóa đến một mức độ nào đó. Từ các lưu ý cân bằng khối lượng, các nồng độ của H+ và HCO3– thì tỷ lệ với nồng độ của H2CO3.

Đối với bất cứ acid nào, nồng độ của acid tương ứng với các ion phân ly của nó thì được định nghĩa bởi hằng số phân li, K’:
K’ = (H+ x HCO3–)/H2CO3 (1)
Phương trình chỉ ra rằng trong một dung dịch H2CO3, lượng H+ tự do bằng với
H+ = K’ x (H2CO3/HCO3–) (2)
Nồng độ của H2CO3 không phân li không thể được đo trong dung dịch bởi vì nó nhanh chóng phân li thành CO2 và H2O hoặc thành H+ và HCO3–. Tuy nhiên, CO2 tan trong máu thì tỷ lệ thuận với lượng H2CO3 không phân ly. Vì thế, phương trình 2 có thể được viết lại như sau:
H+ = K x (CO2/HCO3–) (3)
Hằng số phân li (K) đối với phương trình 3 chỉ khoảng 1/400 so với hằng số phân li (K’) của phương trình 2 bởi vì tỉ số tỷ lệ giữa H2CO3 và CO2 là 1:400.
Phương trình 3 được viết ở dạng tổng lượng CO2 hòa tan trong dung dịch. Tuy nhiên, hầu hết các xét nghiệm lâm sàng đo áp lực CO2 (PCO2) chứ không phải lượng CO2 thực sự. May mắn thay, lượng CO2 trong máu là một hàm tuyến tính của PCO2 nhân với hệ số tan (solubility coefficient) của CO2; dưới các điều kiện sinh lý, hệ số tan đối với CO2 là 0.03 mmol/mm Hg ở nhiệt độ cơ thể. Điều này có nghĩa là 0.03 millimole H2CO3 xuất hiện trong máu đối với mỗi mm Hg PCO2 được đo. Vì thế, phương trình 3 có thể được viết lại như sau
H+ = K x (0.03 x PCO2)/HCO3– (4)
Phương trình Henderson-Hasselbalch. Như được nói đến trước đây, người ta sẽ ưu tiên biểu diễn nồng độ H+ ở các đơn vị pH chứ không phải là các nồng độ thực sự. Nhớ lại là pH = -logH+.
Hằng số phân li (K) có thể được biểu diễn theo một cách tương tự.
pK = -log K
Vì thế, chúng ta có thể biểu diễn nồng độ H+ trong phương trình 4 ở các đơn vị pH bằng cách lấy logarith âm của phương trình đó, sẽ thu được phương trình sau:
-log H+ = -log K – log[(0.03 x PCO2)/HCO3–] (5)
Vì thế,
pH = pK – log[(0.03 x PCO2)/HCO3–] (6)
Để thuận tiện hơn khi phải làm việc với logarith âm, chúng ta có thể thay đổi dấu của logarith và cuối cùng đảo ngược tử số và mẫu số, để thu được phương trình sau đây:
pH = pK + log[HCO3–/(0.03 x PCO2)] (7)
Đối với hệ đệm bicarbonate, pK là 6.1 và phương trình 7 có thể được viết lại như sau:
pH = 6.1 + log[HCO3–/(0.03 x PCO2)] (8)
Phương trình 8 là phương trình Henderson-Hasselbalch và với nó, chúng ta có thể tính toán pH của một dung dịch nếu như nồng độ mole của HCO3– và PCO2 được biết.
Từ phương trình Henderson-Hasselbalch, rõ ràng rằng là một sự tăng lên trong nồng độ HCO3– làm cho pH tăng lên, dịch chuyển cân bằng acid-base về phía tình trạng nhiễm kiềm. Một sự tăng lên trong PCO2 làm cho pH giảm xuống, dịch chuyển cân bằng acid-base về phía tình trạng nhiễm toan.
Phương trình Henderson-Hasselbalch, ngoài xác định các yếu tố quyết định của sự điều hòa pH bình thường và thăng bằng acid-base trong dịch ngoại bào, nó còn cung cấp cái nhìn sâu sắc về sự kiểm soát sinh lý của thành phần acid và base của dịch ngoại bào. Như sẽ được nói đến sau này, nồng độ HCO3– được điều hòa chủ yếu bởi các thận, ngược lại, PCO2 trong dịch ngoại bào được kiểm soát bởi mức độ hô hấp. Bằng cách tăng mức độ hô hấp, các phổi loại bỏ CO2 khỏi huyết tương và bằng cách làm giảm hô hấp, các phổi làm tăng PCO2. Cân bằng nội môi acid-base sinh lý bình thường là do các nỗ lực phối hợp của cả các phổi và các thận, và các rối loạn acid-base xảy ra khi một hoặc cả hai cơ chế kiểm soát này bị suy giảm, vì thế, làm thay đổi nồng độ HCO3– hay PCO2 của dịch ngoại bào.
Khi các rối loạn thăng bằng acid-base do một sự thay đổi chủ yếu trong nồng độ HCO3– dịch ngoại bào, chúng được gọi là các rối loạn acid-base do chuyển hóa (metabolic acid–base disorders). Vì thế, tình trạng nhiễm toan được gây ra bởi một sự giảm chủ yếu trong nồng độ HCO3– được gọi là nhiễm toan chuyển hóa (metabolic acidosis), ngược lại, tình trạng nhiễm kiềm được gây ra bởi một sự tăng lên chủ yếu trong nồng độ HCO3– được gọi là nhiễm kiềm chuyển hóa (metabolic alkalosis). Nhiễm toan được gây ra bởi một sự tăng lên trong PCO2 được gọi là nhiễm toan hô hấp (respiratory acidosis), ngược lại, nhiễm kiềm được gây ra bởi một sự giảm trong PCO2 được gọi là nhiễm kiềm hô hấp (respiratory alkalosis).
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!




































