VI. Sự phosphoryl hóa ADP thành ATP
Sự truyền các electron theo chuỗi truyền electron (ETC) thì thuận lợi về mặt năng lượng bởi vì NADH là một chất cho electron mạnh và O2 là một chất nhận electron mạnh. Tuy nhiên, dòng electron thì không trực tiếp tạo ra sự tổng hợp ATP.
A. Giả thuyết hóa thẩm thấu (chemiosmotic hypothesis)
Giả thuyết hóa thẩm thấu (còn được biết đến là giả thuyết Mitchell) giải thích năng lượng tự do tạo ra từ sự vận chuyển các electron bởi chuỗi truyền electron được sử dụng như thế nào để tạo ra ATP từ ADP + Pi.
1. Bơm proton: Sự vận chuyển electron được bắt cặp với sự phosphoryl hóa ADP bởi sự bơm H+ qua màng trong ty thể, từ chất nền đến khoang gian màng, tại các Complex I, III và IV. Đối với mỗi cặp electron được chuyển từ NADH đến O2 thì 10 H+ sẽ được bơm. Điều này tạo ra một gradient điện thế (với sự tích điện dương hơn ở phía bào tương của màng so với phía chất nền) và một gradient pH (gradient hóa học) (phía bào tương của màng thì ở pH thấp hơn so với phía chất nền), như được thể hiện trên Hình 1. Năng lượng (động lực proton (proton motive force)) được tạo ra bởi các gradients này thì đủ để điều khiển sự tổng hợp ATP. Vì thế, gradient H+ đóng vai trò như là một trong gian chung giúp bắt cặp sự oxy hóa với sự phosphoryl hóa.

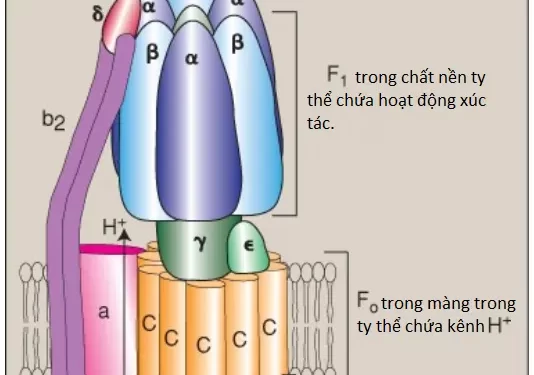
2. Sự tổng hợp ATP: Enzyme gồm nhiều tiểu đơn vị ATP synthase ([Complex V], Hình 2) sẽ tổng hợp ATP sử dụng năng lượng của gradient H+. Nó chứa một miền màng (membrane domain) (F0) trải ra trên màng trong ty thể và một miền ngoại màng (extramembranous domain) (F1) có dạng hình cầu mà nhô vào trong chất nền ty thể (xem Hình 1). Giả thuyết hóa thẩm thấu đã nói rằng sau khi H+ được bơm về phía bào tương của màng trong ty thể, chúng sẽ đi vào lại chất nền bằng cách đi qua một kênh H+ trong miền F0, điều khiển sự xoay của vòng C của F0 và cùng lúc đó, làm mất đi các gradient điện thế và gradient pH. Sự xoay trong F0 gây ra các sự thay đổi cấu hình trong 3 tiểu đơn vị β của F1 và điều này cho phép chúng liên kết ADP + Pi, phosphoryl hóa ADP thành ATP và giải phóng ATP. Một sự xoay hoàn toàn của vòng C sẽ tạo ra 3 ATP. (Chú ý: Sự ATP synthase còn được gọi là F1/F0-ATPase bởi vì enzyme cũng có thể xúc tác sự thủy phân của ATP thành ADP và Pi).

a. Sự bắt cặp trong sự phosphoryl hóa oxy hóa: Trong ty thể bình thường, sự tổng hợp ATP được bắt cặp với sự truyền electron thông qua gradient H+. Tăng (hoặc giảm) một quá trình sẽ có tác động tương ứng lên quá trình còn lại. Ví dụ, sự thủy phân ATP thành ADP và Pi trong các phản ứng yêu cầu năng lượng thì sẽ làm tăng sự có sẵn của các cơ chất cho ATP synthase và vì thế, làm tăng dòng H+ qua enzyme. Chuỗi truyền electron và sự bơm H+ bởi chuỗi truyền electron sẽ tăng để duy trì gradient H+ và cho phép sự tổng hợp ATP.
b. Oligomycin: Thuốc này kết hợp với miền F0 làm đóng kênh H+ và ngăn cản sự vào lại của H+ vào trong chất nền, bằng cách đó, ức chế sự phosphoryl hóa của ADP thành ATP. Bởi vì các gradient điện thế và pH không thể được làm mất đi trong trường hợp có mặt chất ức chế sự phosphoryl hóa nên chuỗi truyền electron ngừng lại do khó khăn trong việc bơm thêm H+ ngược gradient nồng độ quá lớn. Sự phụ thuộc này của hô hấp tế bào vào khả năng phosphoryl hóa ADP thành ATP thì được gọi là sự kiểm soát hô hấp và là kết quả của sự bắt cặp chặt chẽ của các quá trình này.
c. Các proteins hủy bắt cặp: Các protein hủy bắt cặp (uncoupling proteins – UCPs) xuất hiện trong màng trong ty thể của động vật có vú, bao gồm con người. Các protein này hình thành nên các kênh cho phép H+ đi vào lại chất nền ty thể mà không có năng lượng được giữ lại ở dạng ATP (Hình 3). Năng lượng được giải phóng dưới dạng nhiệt, và quá trình được gọi là sự tạo nhiệt không do run (nonshivering thermogenesis). UCP1 còn được gọi là thermogenin, chịu trách nhiệm cho sự tạo thành nhiệt trong các tế bào mỡ nâu giàu ty thể của động vật có vú. (Chú ý: Lạnh có thể làm hoạt hóa sự biểu hiện của UCP1 phụ thuộc catecholamine). Trong mỡ nâu (không giống với mỡ trắng có số lượng nhiều hơn) khoảng 90% năng lượng hô hấp của nó được sử dụng để tạo nhiệt ở các đứa trẻ sơ sinh để đáp ứng với lạnh. Vì thế, mỡ nâu thì liên quan đến sự tiêu tốn năng lượng, ngược lại mỡ trắng thì liên quan đến sự tích trữ năng lượng. (Chú ý: Các sự kết tập mỡ nâu gần đây được thấy là xuất hiện ở người trưởng thành).

d. Các chất hủy bắt cặp tổng hợp: Sự truyền electron và sự phosphoryl hóa của ADP cũng có thể bị hủy bắt cặp bởi các hợp chất giúp chuyển H+ qua màng trong ty thể, làm mất đi gradient. Ví dụ kinh điển của các chất này là 2,4-dinitrophenol, một chất mang H+ ưa lipid (kỵ ion) mà khuếch tán dễ dàng qua màng ty thể (Hình 4). Chất hủy bắt cặp này làm cho sự vận chuyển electron thực hiện ở một tốc độ cao nhưng không thể thiết lập một gradient H+, rất giống với UCP. Một lần nữa, năng lượng được giải phóng dưới dạng nhiệt chứ không phải được sử dụng để tổng hợp ATP. (Chú ý: Ở nồng độ cao, aspirin và các salicylates khác sẽ hủy bắt cặp sự phosphoryl hóa oxy hóa, điều này giải thích việc sốt kèm theo các sự quá liều gây độc của các thuốc này).

B. Các hệ thống vận chuyển màng
Màng trong ty thể thì không thấm với hầu hết các chất tích điện và ưa nước. Tuy nhiên, nó chứa một lượng lớn các protein vận chuyển mà cho phép sự đi qua của các phân tử nhất định từ bào tương đến chất nền ty thể.
1. Sự vận chuyển ATP và ADP: Màng trong ty thể yêu cầu các chất mang chuyển biệt để vận chuyển ADP và Pi từ bào tương (nơi mà ATP được thủy phân thành ADP trong nhiều phản ứng cần năng lượng) vào trong ty thể, nơi mà ATP có thể được tái tổng hợp. Một đối vận (antiporter) adenine nucleotide nhập một ADP từ bào tương vào trong chất nền đồng thời xuất một ATP từ chất nền vào trong bào tương (xem Hình 1). Một đồng vận chuyển vận chuyển đồng thời Pi và H+ từ bào tương vào trong chất nền.
2. Sự vận chuyển đương lượng khử: Màng trong ty thể thiếu một chất vận chuyển NADH và NADH được sản xuất trong bào tương (ví dụ, trong đường phân) không thể đi vào chất nên ty thể một cách trực tiếp. Tuy nhiên, các đương lượng khử của NADH thì được vận chuyển từ bào tương vào trong chất nền nhờ sử dụng các cơ chất vận chuyển. Trong chất vận chuyển glycerol 3-phosphate (Hình 5A), hai electron được vận chuyển từ NADH đến dihydroxyacetone phosphate bởi glyerol 3-phosphate dehydrogenase của bào tương. Glycerol 3-phosphate được sản xuất bị oxy hóa bởi isozyme ty thể khi FAD bị khử thành FADH2. CoQ của chuỗi truyền electron oxy hóa FADH2. Vì thế, các chất vận chuyển glycerol 3-phosphate sẽ tạo ra sự tổng hợp của 2 ATP cho mỗi NADH bào tương được oxy hóa. Điều này thì ngược lại với chất vận chuyển malate-aspartate (Hình 5B), tạo ra NADH (không phải là FADH2) trong chất nền ty thể, bằng cách đó, cho ra 3 ATP cho mỗi NADH bào tương được oxy hóa bởi malate dehydrogenase khi oxaloacetate bị khử thành malate. Một protein vận chuyển giúp di chuyển malate vào trong chất nền ty thể.

C. Các khiếm khuyết di truyền trong sự phosphoryl hóa oxy hóa
13 trong số khoảng 90 polypeptides cần cho sự phosphoryl hóa oxy hóa được mã hóa bởi mtDNA và được tổng hợp trong ty thể, ngược lại các protein còn lại được mã hóa bởi DNA nhân, được tổng hợp trong bào tương và sau đó được vận chuyển vào trong ty thể. Các khiếm khuyết trong sự phosphoryl hóa oxy hóa thì dường như là do các sự thay đổi trong mtDNA, các DNA này có một tỷ lệ đột biến cao hơn 10 lần so với của DNA tế bào. Các tế bào trong các mô có nhu cầu ATP cao bao gồm các tế bào trong não, các dây thần kinh, võng mạc, cơ xương, cơ tim và gan đều có thể dễ bị các tổn thương nhất định. Các sự suy giảm trong quá trình phosphoryl hóa oxy hóa thường gây ra sự nhiễm toan lactic, đặc biệt ở trong các cơ, hệ thống thần kinh trung ương và võng mạc. Các biểu hiện lâm sàng của các rối loạn sự phosphoryl hóa oxy hóa bao gồm co giật (seizure), liệt vận nhãn (ophthalmoplegia), yếu cơ (muscle weakness) và bệnh cơ tim (cardiomyopathy) (Bảng 1). Một số thuốc được biết có tác động lên chức năng ty thể và các thuốc này nên tránh dùng ở những người có các rối loạn ty thể. (Chú ý: mtDNA được di truyền theo mẹ bởi vì ty thể từ tinh trùng không sống sót trong quá trình thụ tinh và chỉ các ty thể từ trứng còn tồn tại trong phôi đang phát triển và ở người trưởng thành).

D. Ty thể và sự chết theo chương trình
Quá trình chết theo chương trình (apoptosis hay programmed cell death) có thể được khởi động qua con đường nội tại (intrinsic) hay qua trung gian ty thể (mitochondrial-mediated) trong đáp ứng với tổn thương không thể sữa chữa bên trong tế bào. Trong suốt quá trình này, các protein kênh (Bax hay Bak) thì được chèn vào trong màng ngoài ty thể và cho phép cytochrome c rời khoang gian màng và vào trong bào tương. Vì thế, cytochrome c liên kết với các yếu tố tiền chết theo chương trình (proapoptotic factors) để hình thành nên một cấu trúc được gọi là apoptosome mà sau đó sẽ hoạt hóa một họ các enzyme phân giải protein (các caspases) gây ra sự phân tách của các protein quan trọng và tạo ra các sự thay đổi trong hình dạng và sinh hóa đặc trưng của sự chết theo chương trình.
VII.Tổng hợp bài viết

- Sự thay đổi trong năng lượng tự do (ΔG) xảy ra trong suốt một phản ứng sẽ giúp dự đoán hướng của phản ứng xảy ra một cách tự phát (Hình 6).
- Nếu như ΔG là âm thì phản ứng sẽ phát triển tự phát theo hướng được vẽ ra. Nếu như ΔG là dương thì phản ứng sẽ không xảy ra một cách tự phát. Nếu như ΔG = 0 thì phản ứng ở trạng thái cân bằng.
- ΔG của một phản ứng thuận thì bằng về độ lớn nhưng ngược dấu với phản ứng nghịch.
- Các phản ứng với một ΔG dương lớn thì có thể được diễn ra bằng cách bắt cặp với một phản ứng có ΔG âm lớn như quá trình thủy phân ATP.
- Các coenzymes khử NADH và FADH2 có thể cho một cặp electron đến một tập hợp các chất mang electron chuyên biệt gồm FMN, các trung tâm Fe-S, CoQ và một loạt các cytochrome chứa heme, được gọi chung là ETC.
- Con đường này thì xuất hiện trong màng trong ty thể và là con đường chung cuối cùng mà các electron có nguồn gốc từ các nguồn nguyên liệu khác nhau của cơ thể đi đến O2, nó có một điện thế khử (E0) dương mạnh, giúp khử O2 thành nước.
- Cytochrome tận cùng, cytochrome c oxidase là cytochrome duy nhất có thể kết hợp với O2.
- Sự truyền electron sẽ tạo ra sự bơm proton (H+) qua màng trong ty thể từ chất nền đến khoang gian màng, 10 H+ cho mỗi NADH bị oxy hóa.
- Quá trình này tạo ra các gradient điện thế và gradient pH qua màng trong ty thể. Sau khi H+ được chuyển đến phía bào tương của màng, chúng sẽ đi vào lại chất nền bằng cách đi qua kênh H+ của F0 trong ATP synthase (Complex V), làm mất đi các gradients điện và pH và gây ra các sự thay đổi cấu hình trong các tiểu đơn vị β của F1 của synthase, điều này sẽ giúp tổng hợp ATP từ ADP và phosphate vô cơ.
- Sự truyền electron và sự phosphoryl hóa thì được bắt cặp chặt chẽ trong sự phosphoryl hóa oxy hóa. Các quá trình này có thể bị hủy bắt cặp bởi UCP1 của màng trong ty thể của các tế bào mỡ nâu và các hợp chất tổng hợp như 2,4-dinitrophenol và aspirin, tất cả các chất này đều làm mất đi gradient H+.
- Trong ty thể không có sự bắt cặp xảy ra, năng lượng được sản xuất bởi sự truyền electron thì sẽ được giải phóng dưới dạng nhiệt chứ không được sử dụng để sản xuất ATP.
- Các khiếm khuyết trong sự phosphoryl hóa oxy hóa thường là do các sự thay đổi trong mtDNA. Các sự suy giảm trong quá trình phosphoryl hóa oxy hóa thường gây ra nhiễm toan lactic, đặc biệt là trong các cơ, hệ thống thần kinh trung ương và võng mạc. Các biểu hiện lâm sàng của các rối loạn phosphoryl hóa oxy hóa bao gồm co giật (seizure), liệt vận nhãn (ophthalmoplegia), yếu cơ (muscle weakness) và bệnh cơ tim (cardiomyopathy).
- Sự giải phóng cytochrome c từ ty thể vào trong bào tương sẽ kích thích sự hình thành của thể apoptosome và sự hoạt hóa tiếp theo của các caspases phân giải protein sẽ tạo ra sự chết theo chương trình của tế bào.
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/nang-luong-sinh-hoc-va-su-phosphoryl-hoa-oxy-hoa/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!