III. Tổng quan về đường phân
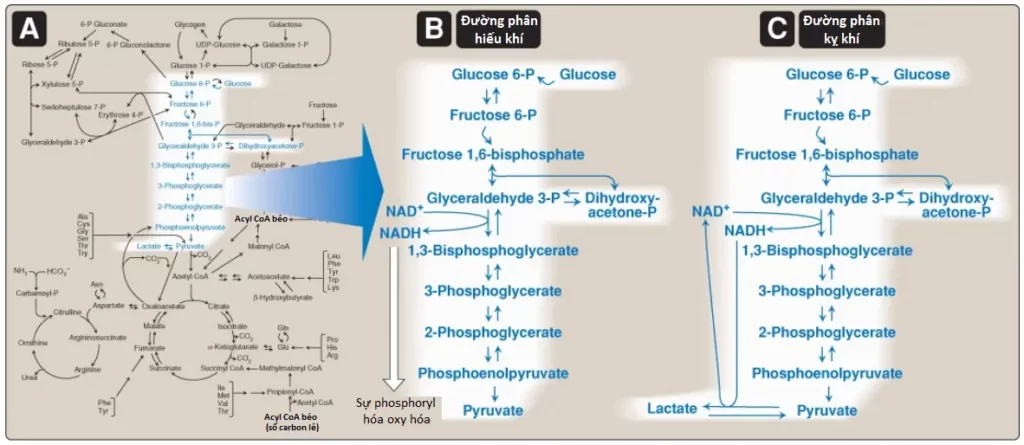
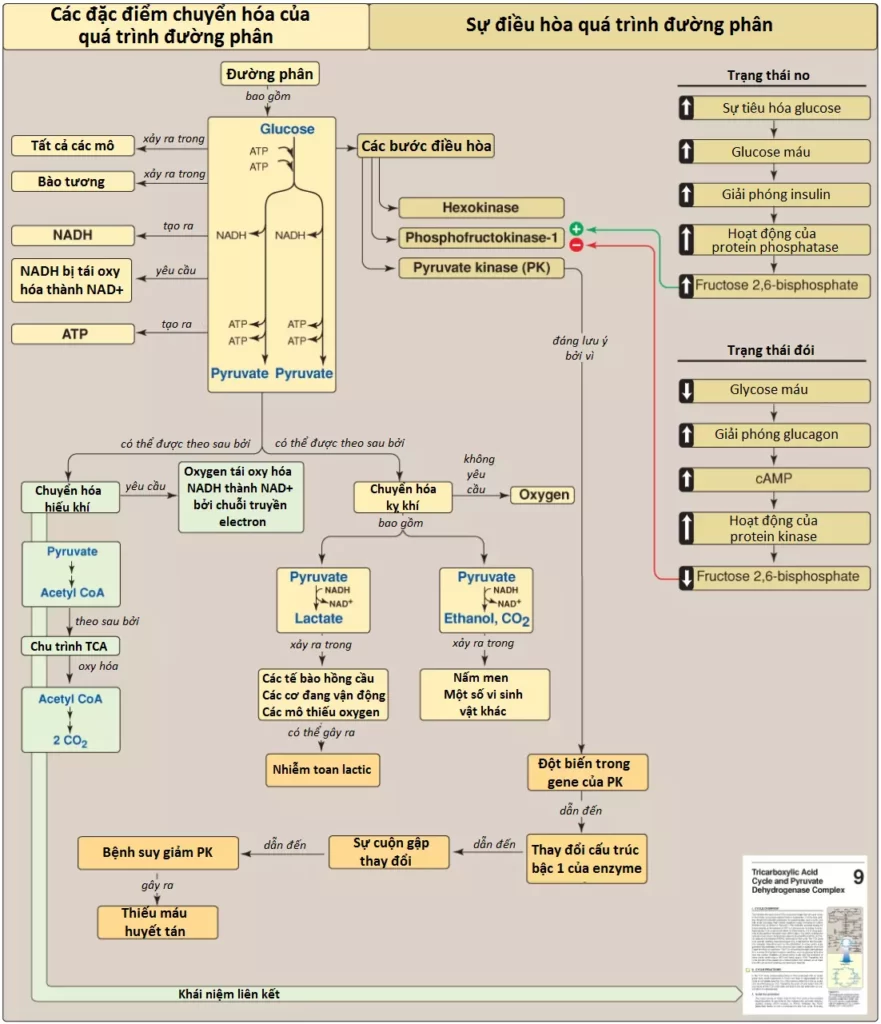
Con đường đường phân được sử dụng bởi tất cả các mô cho sự oxy hóa glucose để cung cấp năng lượng (dưới dạng ATP) và các trung gian cho các con đường chuyển hóa khác. Đường phân là trung tâm của sự chuyển hóa carbohydrate bởi vì trong thực tế tất cả các đường, dù là từ chế độ ăn hay từ các phản ứng dị hóa trong cơ thể thì cuối cùng đều được chuyển thành glucose (Hình 1A). Pyruvate là sản phẩm cuối cùng của quá trình đường phân trong các tế bào chứa ty thể và với một sự cung cấp O2 đầy đủ. Chuỗi 10 phản ứng này được gọi là đường phân hiếu khí (aerobic glycolysis) bởi vì O2 thì cần đến để tái oxy hóa NADH được hình thành trong suốt sự oxy hóa của glyceraldehyde 3-phosphate (Hình 1B). Đường phân hiếu khí thiết lập giai đoạn decarboxyl hóa oxy hóa của pyruvate thành acetyl CoA, một nguyên liệu chính của chu trình TCA. Ngoài ra, pyruvate cũng được khử thành lactate khi NADH bị oxy hóa thành NAD+ (Hình 1C). Sự chuyển đổi này của glucose thành lactate được gọi là đường phân kỵ khí (anaerobic glycolysis) bởi vì nó có thể xảy ra mà không có sự tham gia của O2. Đường phân kỵ khí cho phép sự sản xuất ATP trong các mô mà thiếu ty thể (như các tế bào hồng cầu [RBCs] và các phần của mắt) hoặc trong các tế bào thiếu sự cung cấp O2 đầy đủ (hạ oxygen mô).
IV. Sự vận chuyển glucose vào trong các tế bào
Glucose không thể khuếch tán một cách trực tiếp vào trong các tế bào nhưng nó có thể đi vào trong tế bào bởi một trong 2 hệ thống vận chuyển: một hệ thống vận chuyển không phụ thuộc Na+ và ATP hoặc một hệ thống đồng vận chuyển phụ thuộc Na+ và ATP.
A. Hệ thống vận chuyển không phụ thuộc ion natri và ATP
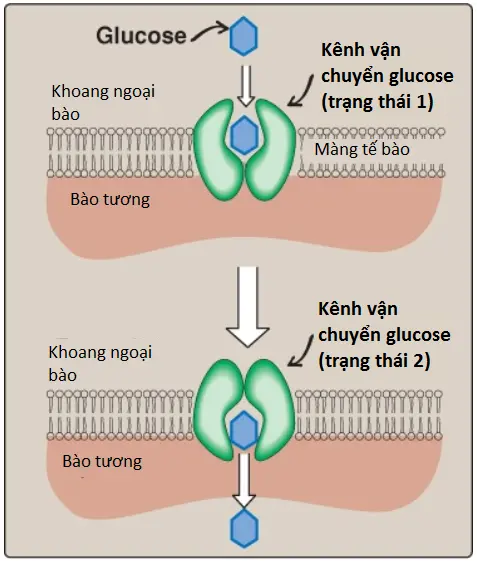
Hệ thống thụ động này được thực hiện bởi một họ 14 isoforms kênh vận chuyển glucose (glucose transporter – GLUT) được tìm thấy trong các màng tế bào. Chúng được định danh từ GLUT-1 đến GLUT-14. Các kênh vận chuyển đơn phân (monomer) protein này tồn tại trong màng ở 2 trạng thái cấu hình (Hình 2). Glucose ngoại bào liên kết với kênh vận chuyển, kênh vận chuyển sau đó thay đổi cấu hình của nó, giúp vận chuyển glucose qua màng tế bào thông qua sự khuếch tán qua trung gian (facilitated diffusion). Bởi vì các GLUTs vận chuyển một phân tử một lúc nên chúng là các kênh đơn vận chuyển (uniporters).
1. Tính đặc hiệu mô: GLUT cho thấy một kiểu biểu hiện đặc hiệu mô (xem Bảng 1 về các ví dụ của một số GLUTs). Ví dụ, GLUT-1 thì có nhiều trong hầu hết các mô, ngược lại, GLUT-4 thì có nhiều trong cơ và trong mô mỡ và GLUT-5 thì vận chuyển fructose. (Chú ý: số lượng các kênh vận chuyển GLUT-4 hoạt động trong các mô này thì được tăng lên bởi insulin [xem các bài viết tiếp theo của mình để hiểu nhé]). GLUT-2 thì có nhiều trong gan, thận và các tế bào β của tụy. Các isoforms GLUT khác thì cũng có sự phân bố đặc hiệu mô.
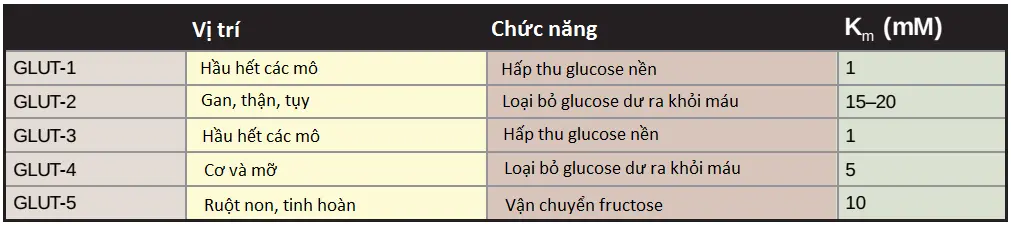
2. Các chức năng chuyên hóa: Trong khuếch tán qua trung gian, sự di chuyển của glucose qua kênh vận chuyển là theo gradient nồng độ (nghĩa là từ nồng độ cao hơn đến nồng độ thấp hơn, vì thế không yêu cầu năng lượng). Ví dụ, GLUT-1, GLUT-3 và GLUT-4 chủ yếu là liên quan đến sự hấp thu glucose từ máu. Ngược lại, GLUT-2, trong gan và thận thì có thể vận chuyển glucose vào trong các tế bào này khi các mức glucose trong máu thì cao hoặc vận chuyển glucose khỏi các tế bào này khi các mức glucose thấp (Ví dụ, trong suốt quá trình đói). GLUT-5 thì không thường gặp mà trong đó nó chủ yếu là kênh vận chuyển của fructose (không phải glucose) trong ruột non và tinh hoàn.
B. Sự đồng vận chuyển glucose phụ thuộc ion natri và ATP
Loại đồng vận chuyển glucose này với ion natri xảy ra trong các tế bào biểu mô của ruột, ống thận và đám rối mạch mạc. Đây là một quá trình cần năng lượng mà giúp vận chuyển glucose chống lại gradient nồng độ của nó, từ nồng độ ngoại bào thấp đến nồng độ nội bào cao hơn trong khi Na+ được vận chuyển theo nồng độ điện hóa của nó. Có một nồng độ ngoại bào cao hơn nhiều so với nồng độ nội bào của Na+, điều này là nhờ vào hoạt động của Na+/K+-ATPase. Gradient nồng độ Na+ làm tăng cường sự vận chuyển của glucose ngược lại gradient nồng độ của nó; sự thủy phân ATP là một nguồn năng lượng gián tiếp bởi vì nó cần để thiết lập gradient Na+ (xem Hình 3). Bởi vì sự vận chuyển tích cực thứ phát này của glucose yêu cầu sự đi vào đồng thời (đồng vận chuyển) của Na+ nên kênh vận chuyển là một kênh đồng vận chuyển glucose phụ thuộc ion natri (SGLT). (Chú ý: Đám rối mạch mạc, một phần của hàng rào máu-não, cũng chứa GLUT-1).
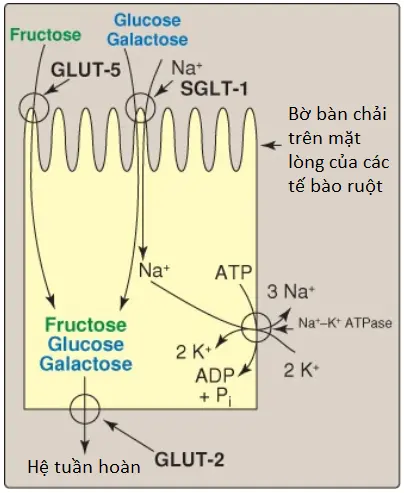
Protein đồng vận chuyển glucose phụ thuộc ion natri 2 (SGLT2) thực hiện chức năng trong thận và là kênh vận chuyển chính cho sự tái hấp thu glucose quay trở vào trong máu. Gliflozin là chất ức chế SGLT2, chất này làm giảm sự tái hấp thu glucose trong thận và vì thế, làm hạ đường máu. Các chất ức chế SGLT2 được sử dụng để điều trị tăng đường huyết ở những người mắc đái tháo đường type II.
V. Các phản ứng đường phân
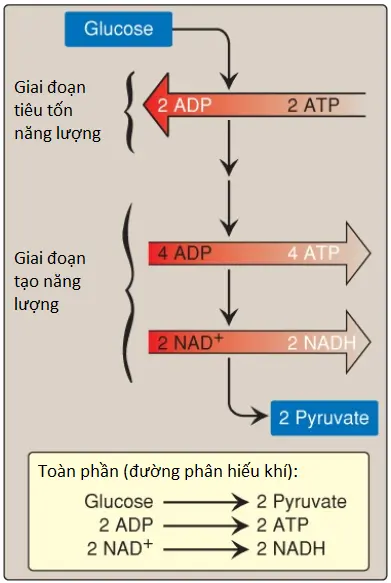
Sự chuyển đổi glucose thành pyruvate xảy ra trong 2 giai đoạn (Hình 4). Năm phản ứng đầu tiên của đường phân tương ứng với một giai đoạn tiêu tốn năng lượng (energy-investment phase) mà trong đó các dạng phosphoryl hóa của các trung gian được tổng hợp bằng việc sử dụng ATP. Các phản ứng kế tiếp của đường phân cấu thành một giai đoạn tạo năng lượng (energy-generation phase) mà trong đó tổng cộng 2 phân tử ATP được hình thành bởi sự phosphoryl hóa cấp độ cơ chất (substrate-level phosphorylation) cho mỗi phân tử glucose chuyển hóa.
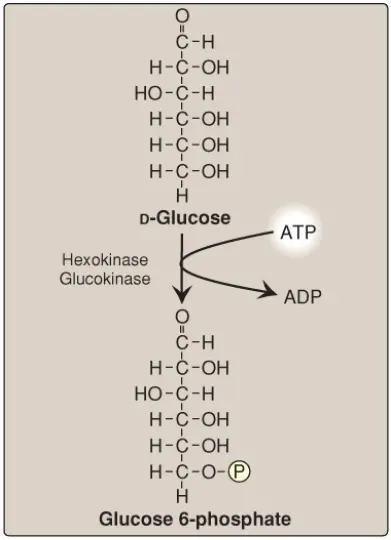
A. Sự phosphoryl hóa glucose
Các phân tử đường phosphoryl hóa không thể đi qua các màng tế bào dễ dàng bởi vì không có các chất mang xuyên màng cho các hợp chất này và bởi vì chúng quá phân cực để khuếch tán qua lõi lipid của các màng. Vì thế, sự phosphoryl hóa không thể đảo ngược glucose (Hình 5) sẽ giữ đường dưới dạng glucose 6-phosphate của bào tương và đưa chúng đến sự chuyển hóa tiếp theo trong tế bào. Các động vật có vú có 4 isozymes (I-IV) của enzyme hexokinase mà xúc tác cho sự phosphoryl hóa của glucose thành glucose 6-phosphate.
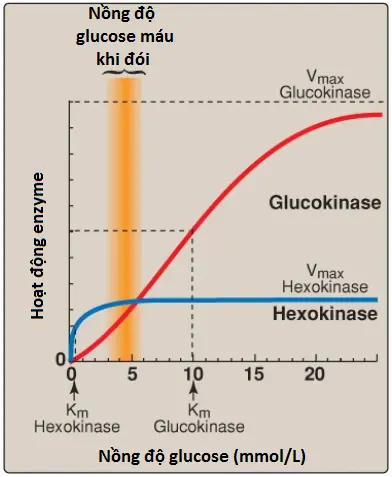
1. Hexokinases I-III: Trong hầu hết các mô, sự phopshoryl hóa glucose được xúc tác bởi một trong số các isozymes hexokinase này, nó là một trong 3 enzymes điều hòa đường phân (cùng với phosphofructokinase [PFK] và pyruvate kinase [PK]). Chúng bị ức chế bởi sản phẩm phản ứng glucose 6-phosphate, thành phần mà sẽ tích tụ lại khi sự chuyển hóa tiếp theo của hexose phosphate này bị giảm. Hexokinase I-III có một hằng số Michaelis thấp (Km) và vì thế nó có một ái tính cao với glucose. Điều này cho phép sự phosphoryl hóa và sự chuyển hóa glucose tiếp theo diễn ra hiệu quả ngay cả khi nồng độ mô của glucose thì thấp (Hình 6). Tuy nhiên, bởi vì các isozymes này có tốc độ tối đa thấp ([Vmax]) đối với glucose nên chúng không giữ phosphate tế bào ở dạng glucose được phosphoryl hóa hay phosphoryl hóa nhiều glucose hơn số lượng mà tế bào có thể sử dụng. (Chú ý: Các isozymes này có tính đặc hiệu cơ chất rộng và có thể phosphoryl hóa một vài hexoses ngoài glucose).
2. Hexokinase IV: Trong các tế bào nhu mô gan và các tế bào β của tụy, glucokinase (enzyme hexokinase IV) là enzyme chủ yếu chịu trách nhiệm cho sự phosphoryl hóa glucose. Trong các tế bào β, glucokinase thực hiện chức năng như là một “cảm biến” glucose (glucose sensor), giúp xác định ngưỡng tiết insulin. (Chú ý: Hexokinase IV cũng đóng vai trò như là một “cảm biến” glucose trong các neurons của vùng dưới đồi, đóng một vai trò quan trọng trong phản hồi adrenergic đối với sự hạ đường huyết). Trong gan, enzyme này thúc đẩy sự phosphoryl hóa glucose trong suốt quá trình tăng đường huyết. Mặc dù có cái tên phổ biến nhưng dễ gây hiểu lầm là glucokinase do tính đặc hiệu đường của enzyme thì tương tự với của các isoenzymes khác.
a. Động lực học: Glucokinase khác so với hexokinase I-III trong một số thuộc tính quan trọng. Ví dụ, nó có Km cao hơn nhiều, do đó, cần một nồng độ glucose cao hơn cho sự bán bão hòa (xem Hình 6). Vì thế, glucokinase chỉ thực hiện chức năng khi mà nồng độ nội bào của glucose trong tế bào gan thì tăng lên như trong suốt một giai đoạn ngắn sau sự tiêu thụ một bữa ăn giàu carbohydrate, khi các mức glucose cao được đưa đến gan thông qua tĩnh mạch cửa. Glucokinase có một Vmax cao, cho phép gan loại bỏ hiệu quả lượng lớn glucose được vận chuyển bởi máu tĩnh mạch cửa. Điều này ngăn cản các lượng lớn glucose đi vào trong hệ thống tuần hoàn hệ thống theo sau một bữa ăn giàu carbohydrate, bằng cách đó làm giảm thiểu sự tăng đường huyết trong suốt giai đoạn hấp thu. (Chú ý: GLUT-2 đảm bảo rằng glucose máu cân bằng một cách nhanh chóng qua màng tế bào gan).
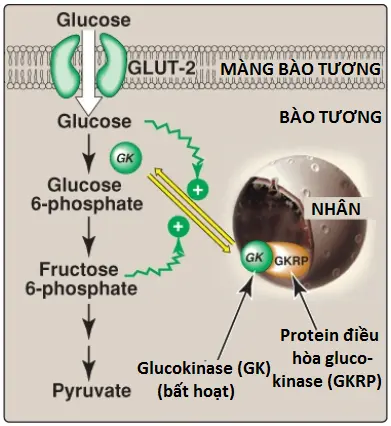
b. Sự điều hòa: Hoạt động của glucokinase thì không bị ức chế một cách trực tiếp bởi glucose 6-phosphate như các hexokinases khác. Thay vào đó, nó bị ức chế một cách gián tiếp bởi fructose 6-phosphate (tồn tại trong sự cân bằng với glucose 6-phosphate, một sản phẩm của glucokinase) và được kích thích một cách gián tiếp bởi glucose (một cơ chất của glucokinase). Sự điều hòa đạt được bởi liên kết thuận nghịch với protein của gan là protein điều hòa glucokinase (glucokinase regulatory protein – GKRP). Khi có mặt fructose 6-phosphate, glucokinase liên kết chặt chẽ với GKRP và được chuyển vị trí đến nhân, bằng cách đó, làm cho enzyme bị bất hoạt (Hình 7). Khi các mức glucose trong máu (và cũng trong tế bào gan, do GLUT-2) tăng, glucokinase được giải phóng khỏi GKRP và enzyme vào lại trong bào tương, nơi mà nó sẽ phosphoryl hóa glucose thành glucose 6-phosphate. (Chú ý: GKRP là một chất ức chế tranh chấp của việc sử dụng glucose bởi glucokinase).
Glucokinase thực hiện chức năng như là một “cảm biến” glucose trong sự hằng định nội môi của glucose máu. Các đột biến bất hoạt glucokinase là nguyên nhân của một dạng đái tháo đường hiếm gặp là đái tháo đường khởi phát lúc trưởng thành của người trẻ type 2 (maturity-onset diabetes of the young type 2 – MODY 2), bệnh được đặc trưng bởi sự suy giảm tiết insulin và tăng đường máu.
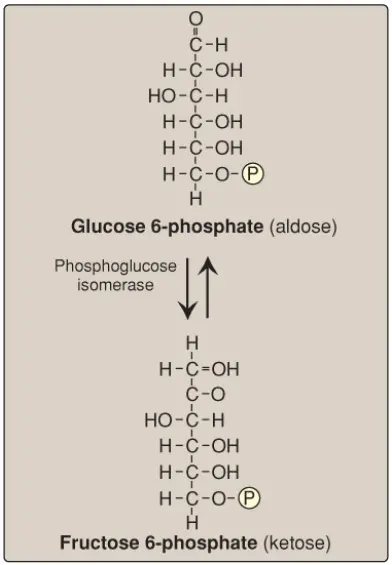
B. Sự isomer hóa của glucose 6-phosphate
Sự isomer hóa của glucose 6-phosphate thành fructose 6-phosphate được xúc tác bởi phosphoglucose isomerase (Hình 8). Phản ứng thì có thể đảo ngược dễ dàng và không phải là một bước giới hạn tốc độ hay bước điều hòa (rate-limiting step or regulatory step).
C. Sự phosphoryl hóa của fructose 6-phosphate
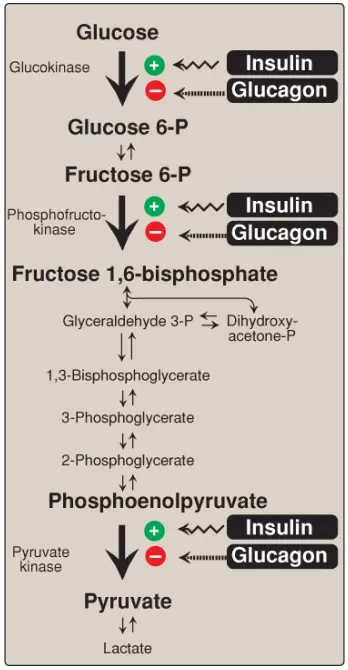
Phản ứng phosphoryl hóa không thể đảo ngược được xúc tác bởi PFK-1 là điểm kiểm soát quan trọng nhất và là bước giới hạn tốc độ (rate-limiting step) và cũng là bước cam kết (committed step) của đường phân (Hình 9). PFK-1 được kiểm soát bởi các nồng độ có sẵn của các chất ATP và fructose 6-phosphate cũng như là các phân tử điều hòa khác.
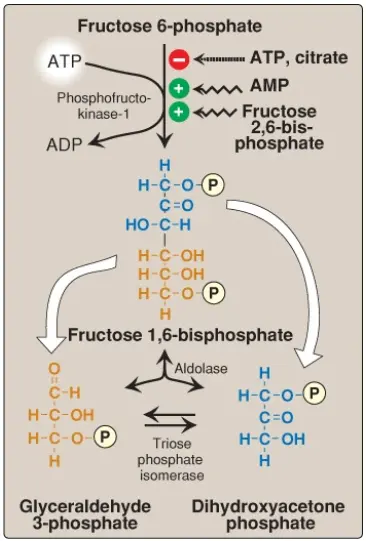
1. Sự điều hòa bởi các mức năng lượng nội bào: PFK-1 bị ức chế bởi sự tăng lên của mức ATP, đóng vai trò như một tín hiệu giàu năng lượng cho thấy sự dồi dào của các hợp chất cao năng lượng. Sự tăng lên của các mức citrate, một trung gian trong chu trình TCA cũng sẽ ức chế PFK-1. (Chú ý: Sự ức chế bởi citrate sẽ tạo điều kiện cho việc sử dụng glucose cho sự tổng hợp glycogen). Ngược lại, PFK-1 được hoạt hóa về mặt dị lập thể bởi các nồng độ cao AMP, là tín hiệu cho thấy rằng năng lượng tích trữ của tế bào đã cạn kiệt.
2. Sự điều hòa bởi fructose 2,6-bisphosphate: Fructose 2,6-bisphosphate là chất hoạt hóa mạnh mẽ nhất của PFK-1 (xem Hình 9) và có thể hoạt hóa enzyme ngay cả khi các mức ATP đang cao. Nó được hình thành từ fructose 6-phosphate bởi PFK-2. Không giống PFK-1, PFK-2 là một protein hai chức năng mà có cả hoạt tính kinase giúp tạo ra fructose 2,6-bisphosphate và hoạt tính phosphatase mà giúp dephosphate hóa fructose 2,6-bisphosphate thành fructose 6-phosphate. Trong isozyme của gan, sự phosphoryl hóa của PFK-2 làm bất hoạt miền kinase và hoạt hóa miền phosphatase (Hình 10). Điều ngược lại được phát hiện thấy trong isozyme của tim. PFK-2 của xương thì không được điều hòa về mặt cộng hóa trị. (Chú ý: Fructose 2,6-bisphosphate là một chất ức chế của fructose 1,6-bisphosphatase, một enzyme của sự tân tạo đường [gluconeogenesis]. Các hoạt động trái ngược của fructose 2,6-biphosphate lên đường phân [hoạt hóa] và tân tạo đường [ức chế] giúp đảm bảo rằng cả hai con đường chuyển hóa thì đều không được hoạt hóa một cách hoàn toàn cùng một lúc, ngăn cản một chu trình oxy hóa glucose không hiệu quả thành pyruvate được theo sau bởi sự tái tổng hợp glucose từ pyruvate).
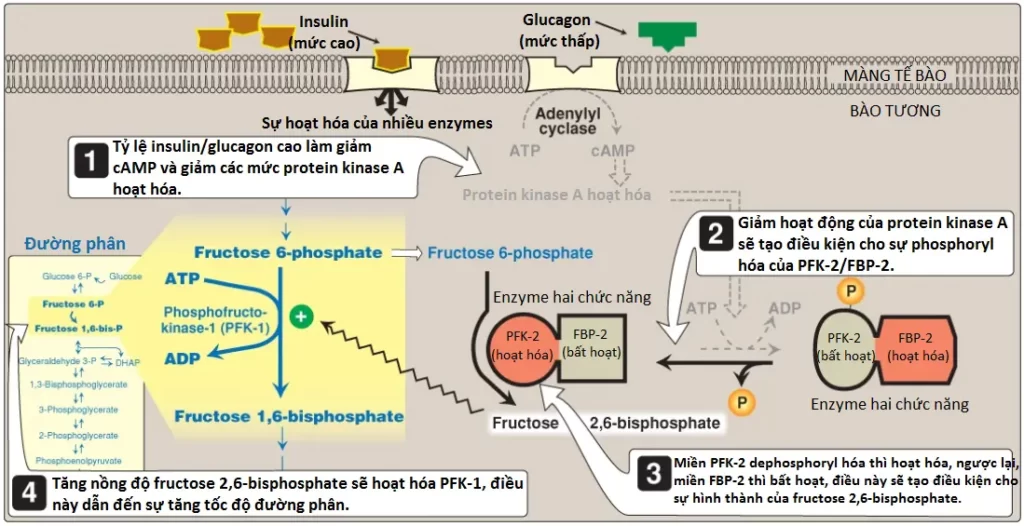
a. Trong suốt giai đoạn ăn no: Mức glucagon giảm và mức insulin tăng (như xảy ra sau một bữa ăn giàu carbohydrate) gây ra một sự tăng lên trong fructose 2,6-bisphosphate của gan (PFK-2 bị dephosphoryl hóa) và vì thế, tăng tốc độ đường phân (xem Hình 10). Vì thế, fructose 2,6-bisphosphate đóng vai trò như là một tín hiệu nội bào của sự dồi dào glucose.
b. Trong suốt quá trình đói: Ngược lại, các mức tăng của glucagon và các mức thấp của insulin mà xảy ra trong suốt quá trình đói gây ra một sự giảm trong fructose 2,6-bisphosphate của gan (PFK-2 được phosphoryl hóa). Điều này gây ra sự ức chế quá trình đường phân và hoạt hóa quá trình tân tạo đường.
D. Sự phân tách fructose 1,6-bisphosphate
Aldolase phân tách fructose 1,6-bisphosphate thành dihydroxyacetone phosphate (DHAP) và glyceraldehyde 3-phosphate (Hình 9). Phản ứng thì có thể được đảo ngược và không được điều hòa. (Chú ý: Aldolase B, isoform của gan, cũng phân tách fructose 1-phosphate và thực hiện chức năng trong sự chuyển hóa fructose của chế độ ăn).
E. Sự isomer hóa của dihydroxyacetone phosphate
Triose phosphate isomerase chuyển đổi giữa DHAP và glyceraldehyde 3-phosphate (Hình 9). DHAP phải được isomer hóa thành glyceraldehyde 3-phosphate cho sự chuyển hóa tiếp theo bởi con đường đường phân. Sự isomer hóa này tạo ra sự sản xuất của tổng cộng 2 phân tử glyceraldehyde 3-phosphate từ các sản phẩm phân tách của fructose 1,6-bisphosphate. (Chú ý: DHAP được sử dụng trong sự tổng hợp triacylglycerol).
F. Sự oxy hóa glyceraldehyde 3-phosphate
Sự chuyển đổi của glyceraldehyde 3-phosphate thành 1,3-bisphosphoglycerate (1,3-BPG) bởi glyceraldehyde 3-phosphate dehydrogenase là phản ứng oxy hóa – khử đầu tiên của đường phân (Hình 11). (Chú ý: Bởi vì có một lượng giới hạn của NAD+ trong tế bào nên NADH hình thành bởi phản ứng của dehydrogenase phải được oxy hóa để cho quá trình đường phân được tiếp tục. Hai cơ chế chính để oxy hóa NADH thành NAD+ là sự khử pyruvate thành lactate bởi lactate dehydrogenase [LDH] kỵ khí và chuỗi truyền electron (electron transport chain [ETC] hiếu khí). Bởi vì NADH không thể đi qua màng trong ty thể nên ETC cần các cơ chất vận chuyển malate-aspartate và glycerol 3-phosphate để đưa các đương lượng khử NADH vào trong chất nền ty thể).
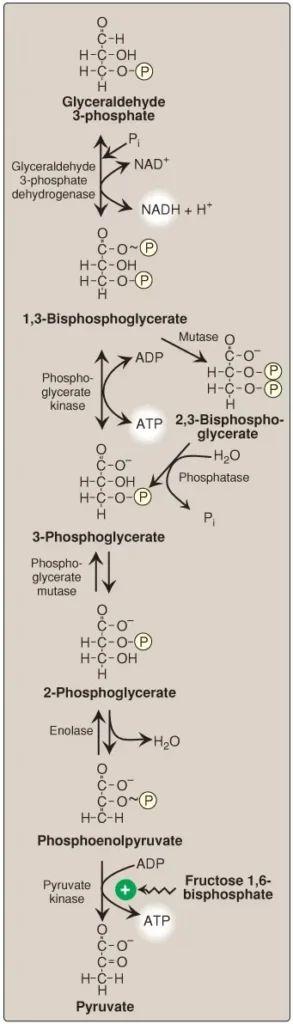
1. Sự tổng hợp 1,3-bisphosphoglycerate: Sự oxy hóa của nhóm aldehyde của glyceraldehyde 3-phosphate thành một nhóm carboxyl thì được bắt cặp với sự nối của Pi vào trong nhóm carboxyl. Nhóm phosphate này, liên kết với carbon 1 của sản phẩm 1,3-BPG bởi một liên kết cao năng lượng, tích trữ phần lớn năng lượng tự do được sản xuất bởi sự oxy hóa glyceraldehyde 3-phosphate. Phosphate cao năng này điều khiển sự tổng hợp ATP trong phản ứng tiếp theo của quá trình đường phân.
Ứng dụng lâm sàng 1: Ngộ độc arsen
Sự ngộ độc arsen chủ yếu là do sự ức chế bởi arsen hóa trị ba (arsenite) của các enzyme như phức hợp pyruvate dehydrogenase (pyruvate dehydrogenase complex – PDHC), cần lipoic acid là một coenzyme. Tuy nhiên, arsen hóa trị năm (arsenate) có thể ngăn chặn sự sản xuất ATP và NADH toàn phần bởi quá trình đường phân mà không ức chế chính con đường chuyển hóa của nó. Arsenate thực hiện được điều này là nhờ tranh chấp với Pi như là một cơ chất cho glyceraldehyde 3-phosphate dehydrogenase, hình thành nên một phức hợp mà thủy phân một cách tự phát để hình thành nên 3-phosphoglycerate (xem Hình 11). Bằng cách bỏ qua sự tổng hợp của 1,3-BPG và sự chuyển phosphate từ 1,3-BPG, tế bào sẽ thiếu năng lượng mà bình thường sẽ thu được từ con đường đường phân. (Chú ý: Arsenate cũng tranh chấp với sự liên kết của Pi vào miền F1 của ATP synthase gây ra sự hình thành của ADP-arsenate mà được thủy phân một cách nhanh chóng).
2. Sự tổng hợp 2,3-bisphosphoglycerate trong tế bào hồng cầu: Một số 1,3-BPG được chuyển thành 2,3-BPG bởi hoạt động của bisphosphoglycerate mutase (Hình 11). 2,3-BPG, được tìm thấy chỉ với các lượng nhỏ trong hầu hết các tế bào nhưng xuất hiện với nồng độ cao trong tế bào hồng cầu và đóng vai trò trong việc làm tăng sự vận chuyển O2. 2,3-BPG bị thủy phân bởi một phosphatase thành 3-phosphoglycerate, cũng là một trung gian trong đường phân (Hình 11). Trong tế bào hồng cầu, quá trình đường phân được sửa đổi bởi sự thêm vào của các phản ứng chuyển hướng này.
G. Sự tổng hợp 3-phosphoglycerate và sự sản xuất ATP
Khi 1,3-BPG được chuyển thành 3-phosphoglycerate thì nhóm phosphate cao năng lượng của 1-3-BPG được sử dụng để tổng hợp ATP từ ADP (Hình 11). Phản ứng này được xúc tác bởi phosphoglycerate kinase, không giống với hầu hết các kinases khác, phản ứng có thể đảo ngược về mặt sinh lý. Bởi vì 2 phân tử 1,3-BPG được hình thành từ mỗi phân tử glucose nên phản ứng của kinase này sẽ đền bù 2 phân tử ATP được tiêu thụ cho sự hình thành trước đó của glucose 6-phosphate và fructose 1,6-bisphosphate. (Chú ý: Phản ứng này là một ví dụ về sự phosphoryl hóa cấp độ cơ chất mà trong đó năng lượng cần cho sự sản xuất một phosphate cao năng đến từ một cơ chất chứ không phải là từ chuỗi truyền electron [ETC]).
H. Sự dịch chuyển nhóm phosphate
Sự dịch chuyển của nhóm phosphate từ carbon 3 đến carbon 2 của phosphoglycerate bởi phosphoglycerate mutase thì có thể đảo ngược một cách dễ dàng.
I. Sự dehydrate hóa 2-phosphoglycerate
Sự dehydrate hóa của 2-phosphoglycerate bởi enolase sẽ phân bố lại năng lượng bên trong cơ chất, hình thành nên phosphoenolpyruvate (PEP), thành phần chứa một enol phosphate cao năng lượng (Hình 11). Phản ứng này thì có thể đảo ngược mặc dù bản chất cao năng lượng của sản phẩm. (Chú ý: Fluoride ức chế enolase và sự fluoride hóa nước sẽ làm giảm sự sản xuất lactate bởi vi khuẩn miệng, làm giảm sâu răng).
J. Sự tổng hợp pyruvate và sự sản xuất ATP
Sự chuyển đổi PEP thành pyruvate, xúc tác bởi PK, là phản ứng không thể đảo ngược thứ ba của đường phân. Enol phosphate cao năng lượng trong PEP được sử dụng để tổng hợp ATP từ ADP và là một ví dụ khác của sự phosphoryl hóa cấp độ cơ chất (Hình 11).
1. Sự điều hòa cấp tiếp (feedforward regulation): PK được hoạt hóa bởi fructose 1,6-bisphosphate, sản phẩm của phản ứng PFK-1. Sự điều hòa cấp tiếp này (thay vì sự điều hòa phản hồi phổ biến hơn) có tác động của sự liên kết hai hoạt động kinase: tăng hoạt động của PFK-1 gây ra sự tăng lên của mức fructose 1,6-bisphosphate, chất mà sẽ hoạt hóa PK. (Chú ý: PK bị ức chế bởi ATP).
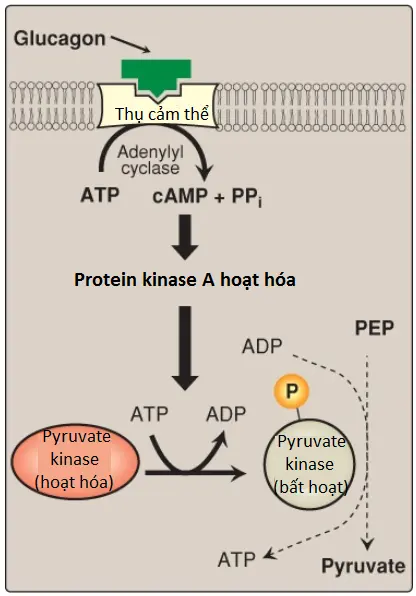
2. Sự điều hòa cộng hóa trị trong gan: Sự phosphoryl hóa bởi PKA phụ thuộc cAMP dẫn đến sự bất hoạt của isozyme PK của gan (Hình 12). Khi các mức glucose máu thấp, sự tăng lên trong glucagon sẽ làm tăng mức nội bào của cAMP, điều này sẽ dẫn đến sự phosphoryl hóa và sự bất hoạt của PK chỉ trong gan. Vì thế, PEP thì không thể tiếp tục trong quá trình đường phân và thay vào đó, nó đi vào con đường tân tạo đường. Điều này giải thích một phần cho sự ức chế quá trình đường phân của gan có thể thấy được và sự kích thích quá trình tân tạo đường bởi glucagon. Sự dephosphoryl hóa của PK bởi một phosphatase gây ra sự tái hoạt hóa của enzyme.
3. Sự suy giảm pyruvate kinase: Bởi vì các tế bào hồng cầu trưởng thành thiếu ty thể nên chúng hoàn toàn phụ thuộc vào quá trình đường phân để sản xuất ATP. ATP thì cần thiết để đáp ứng các nhu cầu chuyển hóa của các tế bào hồng cầu và để cung cấp năng lượng cho các bơm ion cần cho sự duy trì tính linh động, hình dạng lõm hai mặt để cho phép chúng có thể nén lại qua các mao mạch hẹp. Sự thiếu máu quan sát được trong sự suy giảm enzyme đường phân là kết quả của sự giảm tốc độ đường phân, dẫn đến sự giảm sản xuất ATP bởi sự phosphoryl hóa mức độ cơ chất. Các thay đổi kết quả trong màng hồng cầu dẫn đến các sự thay đổi trong hình dạng tế bào và cuối cùng là dẫn đến sự thực bào bởi các tế bào của hệ thống thực bào đơn nhân, đặc biệt là các đại thực bào của lách. Chết non và sự phân giải của hồng cầu sẽ gây ra thiếu máu tán huyết từ nhẹ đến nặng, với thể nặng thì cần phải truyền máu thường xuyên. Trong số các bệnh nhân có các khiếm khuyết di truyền hiếm của các enzyme đường phân thì phần lớn là có một sự suy giảm trong PK. (Chú ý: PK của gan được mã hóa bởi cùng một gene với isozyme hồng cầu. Tuy nhiên, các tế bào gan thì không cho thấy ảng hưởng bởi vì chúng có thể tổng hợp nhiều PK hơn và cũng có thể tạp ra ATP bằng sự phosphoryl hóa oxy hóa). Mức độ nặng phụ thuộc vào cả mức độ suy giảm enzyme (nhìn chung là 5% đến 35% mức bình thường) và vào mức độ mà hồng cầu đền bù bằng cách tăng tổng hợp 2,3-BPG. Hầu hết tất cả những người có sự suy giảm PK thì sẽ có một enzyme đột biến mà cho thấy sự thay đổi động lực học hay sự giảm tính ổn định (Hình 13). Những người mang thể dị hợp đối với tình trạng suy giảm PK sẽ kháng với hầu hết các thể nặng của sốt rét.
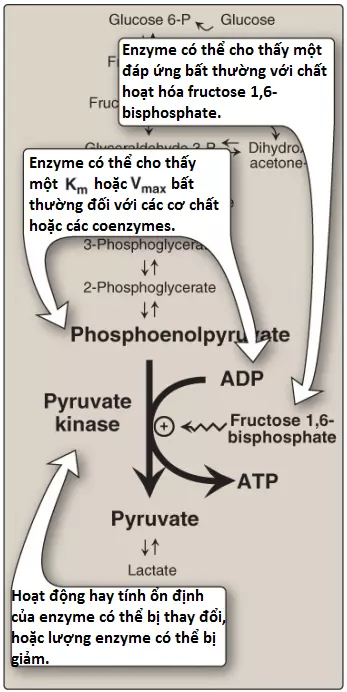
Sự biểu hiện đặc hiệu mô của PK trong tế bào hồng cầu và trong tế bào gan là do việc sử dụng các vị trí bắt đầu phiên mã khác nhau của gene mã hóa enzyme.
K. Sự khử pyruvate thành lactate
Lactate, được hình thành từ pyruvate bởi LDH, là sản phẩm cuối cùng của quá trình đường phân kỵ khí trong các tế bào nhân thực (Hình 14). Sự khử thành lactate là số phận của pyruvate trong các mô mà được cung cấp mạch máu kém (như thủy tinh thể và giác mạc của mắt và tủy thận) hoặc trong tế bào hồng cầu mà thiếu ty thể.
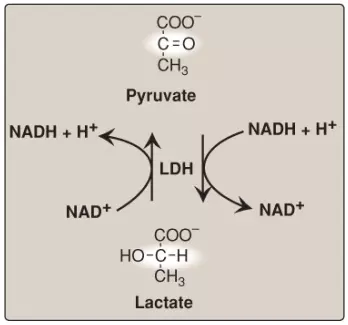
1. Sự hình thành lactate trong cơ: Trong cơ xương luyện tập thể thao, sự sản xuất NADH (bởi glyceraldehyde 3-phosphate dehydrogenase và bởi 3 dehydrogenases liên kết NAD+ của chu trình TCA) vượt quá khả năng oxy hóa của ETC. Điều này gây ra một sự tăng lên trong tỷ lệ NADH/NAD+, tạo điều kiện thuận lợi cho sự khử pyruvate thành lactate bởi LDH. Vì thế, trong suốt quá trình luyện tập thể thao mạnh, lactate tích tụ trong cơ, gây ra một sự sụt giảm trong pH nội bào, nguy cơ gây ra chuột rút. Hầu hết lactate này cuối cùng khuếch tán vào trong dòng máu và có thể được sử dụng bởi gan để tạo thành glucose.
2. Sự sử dụng lactate: Hướng của phản ứng LDH phụ thuộc vào các nồng độ tương đối của pyruvate và lactate và tỷ số NADH/NAD+. Ví dụ, trong gan và tim, tỷ số này thì thấp hơn trong cơ đang luyện tập thể thao. Kết quả là, gan và tim oxy hóa lactate (thu được từ dòng máu) thành pyruvate. Trong gan, pyruvate thì được chuyển thành glucose bởi quá trình tân tạo đường hoặc được chuyển thành acetyl CoA mà bị oxy hóa trong chu trình TCA. Cơ tim chỉ oxy hóa lactate thành carbon dioxide và nước thông quan chu trình TCA.
3. Nhiễm toan lactic: Sự tăng lên trong nồng độ lactate trong bào tương, được gọi là sự nhiễm toan lactic (một dạng nhiễm toan chuyển hóa), xảy ra khi có một sự suy giảm tuần hoàn máu, như trong nhồi máu cơ tim, thuyên tắc phổi và chảy máu không kiểm soát hoặc khi một người đang trong tình trạng shock. Sự suy giảm khả năng mang đủ lượng O2 đến các mô sẽ gây ra một sự suy giảm quá trình phosphoryl hóa oxy hóa và giảm sự tổng hợp ATP. Để tồn tại, các tế bào dựa vào quá trình đường phân kỵ khí để tạo ra ATP, hình thành acid lactic như là sản phẩm cuối cùng. (Chú ý: Sự sản xuất các lượng ATP dù là ít nhưng có thể cứu sống mô trong suốt giai đoạn cần để tái thiết lưu lượng máu đầy đủ đến các mô). Lượng O2 thêm cần để hồi phục từ một giai đoạn khi mà lượng O2 có sẵn là không đầy đủ được gọi là “nợ O2“. (Chú ý: “Nợ O2” thì thường liên quan đến mức độ bệnh tật và tỷ lệ tử vong của bệnh nhân. Trong nhiều tình huống lâm sàng, đo mức acid lactic máu cho phép sự phát hiện nhanh và sớm “nợ O2” ở các bệnh nhân và theo dõi sự hồi phục của họ).
L. Sự tạo năng lượng từ quá trình đường phân
Mặc cho sự sản xuất một số ATP bởi sự phosphoryl hóa cấp độ cơ chất trong suốt quá trình đường phân nhưng sản phẩm cuối cuối cùng, pyruvate hay lactate, vẫn sẽ chứa hầu hết năng lượng ban đầu chứa trong glucose. Chu trình TCA thì cần thiết để giải phóng năng lượng đó một cách hoàn toàn.
1. Quá trình đường phân kỵ khí: Hai phân tử ATP toàn phần được tạo ra đối với mỗi phân tử glucose được chuyển thành các phân tử lactate (Hình 15). Không có sự sản xuất hay tiêu thụ NADH toàn phần.
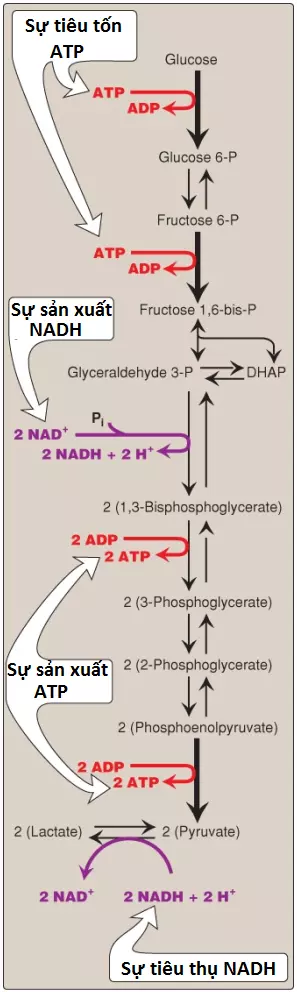
2. Quá trình đường phân hiếu khí: Sự tạo thành ATP thì giống với quá trình đường phân kỵ khí (nghĩa là một sự thu được toàn phần của 2 ATP cho mỗi phân tử glucose). Hai phân tử NADH cũng được tạo ra đối với mỗi phân tử glucose. Quá trình đường phân hiếu khí đang diễn ra cần sự oxy hóa của hầu hết NADH này bởi chuỗi truyền electron (ETC), tạo ra 3 ATP cho mỗi phân tử NADH đi vào trong chuỗi. (Chú ý: NADH không thể đi qua màng trong ty thể và các cơ chất vận chuyển thì được cần đến).
VI. Sự điều hòa hormone
Sự điều hòa hoạt động của các enzymes đường phân không thể đảo ngược bởi sự hoạt hóa/ức chế dị lập thể hoặc sự phosphoryl hóa/dephosphoryl hóa là ngắn hạn (nghĩa là các tác động xảy ra trong vòng vài phút hoặc vài giờ). Cùng với các tác động này lên hoạt động của các phân tử enzyme đã tồn tại trước đó là các tác động hormone dài hạn lên số lượng các phân tử enzyme mới. Các tác động hormone này có thể làm tăng 10 đến 20 lần sự tổng hợp enzyme mà thường diễn ra sau vài giờ hoặc vài ngày.
Sự tiêu thụ thường xuyên các bữa ăn giàu carbohydrate hay sử dụng insulin sẽ khởi động một sự tăng lên trong lượng glucokinase, PFK-1 và PK trong gan (Hình 16). Sự thay đổi này phản ánh một sự tăng lên trong quá trình phiên mã gene, gây ra sự tăng tổng hợp enzyme. Tăng sự có mặt của các enzymes này sẽ tạo điều kiện cho sự chuyển đổi glucose thành pyruvate, một đặc điểm của trạng thái hấp thu. (Chú ý: Các tác động phiên mã của insulin và carbohydrate [đặc biệt là glucose] được thực hiện lần lượt bởi các yếu tố phiên mã protein-1c liên kết thành phần điều hòa sterol (sterol regulatory element–binding protein-1c – SREBP-1c) và protein liên kết thành phần đáp ứng carbohydrate (carbohydrate response element-binding protein – ChREBP). Các yếu tố này cũng điều hòa sự phiên mã của các genes liên quan đến sự tổng hợp acid béo). Ngược lại, sự biểu hiện gene của 3 enzymes bị giảm khi glucagon huyết tương cao và insulin thấp (ví dụ, gặp trong trạng thái đói hay bị tiểu đường).
VII. Các số phận khác của pyruvate
Pyruvate có thể được chuyển hóa thành các sản phẩm khác lactate.
A. Sự decarboxyl hóa thành acetyl CoA
Sự decarboxyl hóa oxy hóa của pyruvate bởi PDHC là một con đường chuyển hóa quan trọng trong các mô có khả năng oxy hóa cao như cơ tim (Hình 17). PDHC giúp chuyển đổi không thể đảo ngược pyruvate, sản phẩm cuối cùng của quá trình đường phân hiếu khí, thành acetyl CoA, một cơ chất của chu trình TCA và là nguồn carbon cho sự tổng hợp acid béo.
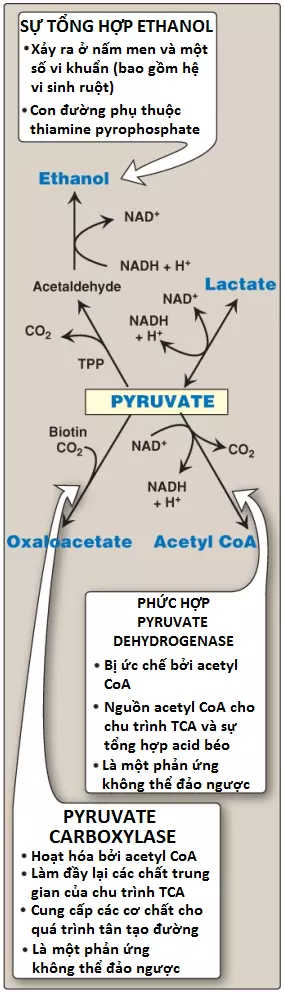
B. Sự carboxyl hóa thành oxaloacetate
Sự carboxyl hóa pyruvate thành oxaloacetate bởi pyruvate carboxylase là một phản ứng phụ thuộc biotin (Hình 17). Phản ứng không thể đảo ngược này thì quan trọng bởi vì nó làm đầy lại trung gian của chu trình TCA và cung cấp cơ chất cho quá trình tân tạo đường.
C. Sự khử thành ethanol (các vi sinh vật)
Sự khử pyruvate thành ethanol xảy ra bởi 2 phản ứng được tổng hợp trong Hình 17. Sự decarboxyl hóa pyruvate thành acetaldehyde bởi pyruvate decarboxylase yêu cầu thiamine xảy ra trong nấm men và các vi sinh vật nhất định khác mà không phải là ở con người.
VIII. Tổng hợp chương
- Hầu hết các con đường chuyển hóa có thể được phân thành dị hóa (thoái hóa các phân tử phức tạp thành một số sản phẩm đơn giản với sự sinh ra ATP) hoặc đồng hóa (tổng hợp các sản phẩm cuối cùng phức tạp từ các tiền thân đơn giản với sự thủy phân ATP).
- Sự truyền tín hiệu gian bào cung cấp tính kết hợp của chuyển hóa. Con đường truyền tín hiệu chủ yếu là truyền tín hiệu hóa học (ví dụ, bởi các hormone và các chất dẫn truyền thần kinh).
- Các phân tử truyền tin thứ hai được điều hòa trong sự đáp ứng với GPCR và giúp chuyển đổi từ một tín hiệu hóa học thành các đáp ứng nội bào thích hợp.
- Adenylyl kinase là một enzyme màng tế bào được điều hòa bởi GPCR mà xúc tác cho sự tổng hợp AMP vòng (cAMP) trong đáp ứng với các hormone glucagon và epinephrine.
- cAMP được sản xuất sẽ hoạt hóa PKA, enzyme này sẽ phosphoryl hóa nhiều loại enzymes, trên các gốc serine/threonine, gây ra sự hoạt hóa hoặc bất hoạt của chúng.
- Sự phosphoryl hóa thì được đảo ngược bởi các phosphoprotein phosphatases.
- Quá trình đường phân hiếu khí mà trong đó pyruvate là sản phẩm cuối cùng sẽ xảy ra trong các tế bào có ty thể và có một sự cung cấp oxygen [O2] đầy đủ (Hình 18).
- Quá trình đường phân kỵ khí mà trong đó lactic acid là sản phẩm cuối cùng sẽ xảy ra bên trong các tế bào mà thiếu ty thể và trong các tế bào mà thiếu sự cung cấp O2 đầy đủ.
- Glucose được vận chuyển một cách thụ động qua các màng tế bào bởi các kênh GLUTs, các kênh vận chuyển này thì có sự phân bố đặc hiệu mô.
- Sự oxy hóa glucose thành pyruvate (quá trình đường phân, xem Hình 18) xảy ra trong suốt giai đoạn tiêu tốn năng lượng mà trong đó các trung gian phosphoryl hóa được tổng hợp nhờ sự tiêu tốn ATP và giai đoạn tạo năng lượng mà trong đó ATP được sản xuất bởi sự phosphoryl hóa cấp độ cơ chất.
- Hexokinase có một ái tính cao (Km thấp) và một tốc độ tối đa (Vmax) thấp đối với glucose và bị ức chế bởi glucose 6-phosphate. Glucokinase có một Km cao và một Vmax cao đối với glucose. Nó được điều hòa một cách gián tiếp bởi fructose 6-phosphate (ức chế) và glucose (hoạt hóa) thông qua GKRP.
- Glucose 6-phosphate được isomer hóa thành fructose 6-phosphate, chất này được phosphoryl hóa thành fructose 1,6-bisphosphate bởi PFK-1. Tổng cộng có 2 ATPs được sử dụng trong suốt giai đoạn này của quá trình đường phân.
- Fructose 1,6-bisphosphate được phân tách để hình thành nên 2 triose mà sẽ được chuyển hóa tiếp bởi con đường đường phân để hình thành nên pyruvate. Trong suốt giai đoạn này, 4 ATPs và 2 NADHs được sản xuất cho mỗi phân tử glucose.
- Bước cuối cùng trong sự tổng hợp pyruvate từ PEP được xúc tác bởi PK. Sự suy giảm PK chiếm phần lớn các khiếm khuyết di truyền trong các enzyme đường phân. Các tác động thì sẽ giới hạn đối với tế bào hồng cầu và biểu hiện bởi thiếu máu tán huyết mạn tính từ nhẹ đến nặng.
- Sự phiên mã gene của quá trình đường phân được tăng cường bởi insulin và glucose.
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/gioi-thieu-ve-chuyen-hoa-va-duong-phan-phan-1/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!





































