I. Tổng quan
Trong thực tế thì tất cả các phản ứng bên trong cơ thể đều sẽ được điều hòa bởi các enzyme, là các các chất xúc tác có bản chất protein, thường ở bên trong tế bào, giúp làm tăng tốc độ các phản ứng mà không bị thay đổi quá trình tổng quan. Giữa các phản ứng sinh học mà có thể xảy ra về mặt năng lượng, các enzyme sẽ điều hướng một cách chọn lọc các chất tham gia phản ứng hay các cơ chất vào trong những con đường chuyển hóa có ích. Vì thế, các enzyme sẽ có vai trò điều khiển tất cả các sự kiện chuyển hóa. Bài viết này và bài viết sau sẽ giúp các bạn khám phá về bản chất của các phân tử xúc tác này và các cơ chế hoạt động của chúng nhé.
II. Danh pháp
Mỗi enzyme sẽ được gán với 2 tên. Tên đầu tiên là tên ngắn của enzyme, là tên được khuyến cáo sử dụng và thuận tiện cho việc sử dụng thường xuyên. Tên thứ hai là tên theo hệ thống hoàn chỉnh, được sử dụng khi mà một enzyme phải được xác định rõ ràng, không mơ hồ.
A. Tên khuyến cáo
Các tên enzyme được sử dụng thường xuyên nhất sẽ có hậu tố “-ase” nối với cơ chất của phản ứng như glucosidase và urease. Các tên của các enzymes khác sẽ bao gồm một sự mô tả về hoạt động mà chúng thực hiện, ví dụ, lactate dehydrogenase (LDH) và adenylyl cyclase. Một số enzyme thì sẽ giữ lại các tên thông thường ban đầu mà không có bất kỳ liên quan nào đến phản ứng enzyme đó thực hiện, ví dụ, trypsin và pepsin.
B. Tên hệ thống
Trong hệ thống đặt tên enzyme, các enzyme được chia thành 6 nhóm chính (Hình 1), mỗi nhóm sẽ có nhiều nhóm nhỏ. Đối với một enzyme cho trước thì hậu tố “-ase” được nối vào một trong một mô tả tương đối hoàn trình về phản ứng hóa học mà enzyme đó xúc tác, bao gồm các tên của tất cả các cơ chất, ví dụ, lactate:nicotinamide adenine dinucleotide (NAD+) oxidoreductase. (Chú ý: Mỗi enzyme thì cũng được gán với một con số phân loại. Với lactate:NAD+ oxidoreductase là 1.1.1.27.). Các tên hệ thống thì rất rõ ràng và đầy đủ thông tin nhưng lại quá cồng kềnh để có thể được sử dụng một cách rộng rãi thường xuyên.

Danh pháp enzyme dễ gây nhầm lẫn bao gồm các enzyme có các tên tương tự nhưng có các chức năng hay cơ chế khác nhau khác nhau. Ví dụ, các synthetases yêu cầu ATP, trong khi các synthases thì không yêu cầu năng lượng. Các phosphatases sử dụng nước để loại bỏ đi một nhóm phosphate trong khi các phosphorylases sử dụng phosphate vô cơ để bẻ gãy một liên kết và tạo ra một sản phẩm được phosphoryl hóa. Dehydrogenases (sử dụng NAD+ hay flavin adenine dinucleotide, FAD) nhận các electrons trong một phản ứng oxy hóa-khử. Oxidases sử dụng oxygen như là một chất nhận mà không có các nguyên tử oxygen được tích hợp vào trong cơ chất, trong khi các oxygenases thì sẽ có sự tích hợp các nguyên tử oxy vào trong các cơ chất của chúng.
III. Các thuộc tính
Một enzyme là một chất xúc tác có bản chất protein đặc hiệu và hiệu quả, nó kết hợp với một cơ chất ở vị trí hoạt động của enzyme và thực hiện vai trò hóa học trên cơ chất đó để chuyển nó thành sản phẩm cần thiết. Nếu như không có các enzyme thì hầu hết các phản ứng sinh hóa sẽ không xảy ra đủ nhanh để có vai trò về mặt sinh lý trong cơ thể con người. Các enzyme làm tăng tốc độ của một phản ứng hóa học, chúng sẽ không được sử dụng trong suốt quá trình phản ứng. (Chú ý: Một số ribonucleic acids [RNAs] có thể xúc tác các phản ứng mà ảnh hưởng đến các liên kết phosphodiesterase và peptide. Các RNAs có hoạt động xúc tác được gọi là các ribozymes và thường ít gặp hơn nhiều so với các chất xúc tác có bản chất protein.)
A. Vị trí hoạt động
Các phân tử enzymes chứa một khe hay hốc đặc hiệu được gọi là vị trí hoạt động, được hình thành do sự cuộn gấp của phân tử protein. Vị trí hoạt động chứa các gốc amino acids mà có các chuỗi bên tham gia vào trong sự liên kết với cơ chất và sự xúc tác (Hình 2). Cơ chất đầu tiên sẽ liên kết với enzyme, hình thành nên một phức hợp enzyme-cơ chất (ES). Sự liên kết thì được cho là sẽ gây ra một sự thay đổi về cấu hình trong enzyme (mô hình phù hợp cảm ứng), cho phép một sự chuyển đổi nhanh của ES thành phức hợp enzyme-sản phẩm (EP) mà cuối cùng sẽ phân ly để giải phóng ra enzyme và sản phẩm.

B. Hiệu suất
Các phản ứng được xúc tác bởi enzyme thì có hiệu suất cao, thực hiện nhanh gấp 103 cho đến 108 lần so với các phản ứng không được xúc tác bởi enzyme. Số lượng các phân tử cơ chất được chuyển thành sản phẩm trên mỗi phân tử enzyme trên mỗi giây được gọi là số sản phẩm chuyển đổi mỗi giây (turnover number), hay kcat và thường có giá trị là từ 102 đến 104 giây-1. (Chú ý: kcat là hằng số tốc độ cho sự chuyển đổi của ES thành E + P).
C. Tính đặc hiệu
Các enzyme thì có tính đặc hiệu cao và có khả năng tương tác với một hoặc một số rất ít các cơ chất và chỉ có thể xúc tác cho một loại phản ứng hóa học. Tập hợp các enzymes được tổng hợp bên trong một tế bào sẽ xác định các loại phản ứng xảy ra bên trong tế bào đó.
D. Các holoenzymes, các apoenzymes, các đồng yếu tố và các coenzymes
Một số enzymes cần các thành phần không phải là protein để có thể có hoạt tính của enzyme. Thuật ngữ “holoenzyme” đề cập đến thành phần protein của enzyme cùng với thành phần không phải protein của enzyme, ngược lại, enzyme mà không có thành phần không phải là protein được gọi là “apoenzyme” và bị bất hoạt. Đối với các enzymes mà cần các thành phần không phải protein thì các thành phần đó phải có mặt để cho enzyme thực hiện chức năng xúc tác.
Nếu như thành phần không phải protein là một ion kim loại như kẽm (Zn2+) hay sắt (Fe2+) thì nó được gọi là đồng yếu tố (cofactor). Nếu như nó là một phân tử hữu cơ nhỏ thì nó được gọi là coenzyme. Các coenzymes hay các đồng cơ chất chỉ tạm thời liên kết với enzyme và phân ly khỏi enzyme khi thay đổi trạng thái (ví dụ, NAD+). Nếu như coenzyme được liên kết với enzyme vĩnh viễn và trở về hình dạng ban đầu của nó thì nó được gọi là nhóm ngoại (ví dụ, FAD). Các coenzymes thường có nguồn gốc từ các vitamins. Ví dụ, NAD+ chứa niacin và FAD chứa riboflavin.
E. Sự điều hòa
Hoạt động của enzyme thường có thể được tăng lên hoặc giảm xuống sao cho tốc độ hình thành sản phẩm có thể đáp ứng với các nhu cầu của tế bào hiện tại.
F. Vị trí bên trong tế bào
Hầu hết các enzymes thực hiện chức năng ở bên trong các tế bào và được giữ ở bên trong bởi các màng tế bào. Nhiều enzymes được định vị trong các bào quan chuyên biệt trong tế bào (Hình 3). Sự phân chia khu vực như thế này đóng vai trò trong việc cách ly cơ chất hay sản phẩm phản ứng khỏi các phản ứng tranh chấp khác. Điều này giúp cung cấp một môi trường thích hợp cho phản ứng và tổ chức hàng ngàn enzymes bên trong tế bào theo các con đường chuyển hóa phù hợp với mục đích.

IV. Cơ chế hoạt động của enzyme
Cơ chế hoạt động của enzyme có thể được xem xét từ 2 khía cạnh khác nhau. Khía cạnh đầu tiên là xem xét sự xúc tác bằng các sự thay đổi năng lượng xảy ra trong suốt quá trình phản ứng. Nghĩa là, các enzymes cung cấp một con đường phản ứng thích hợp về mặt năng lượng thay thế khác so với phản ứng không được xúc tác. Khía cạnh thứ hai sẽ giúp mô tả cách mà vị trí hoạt động tạo điều kiện cho sự xúc tác về mặt hóa học.
A. Các sự thay đổi năng lượng xảy ra trong suốt quá trình phản ứng
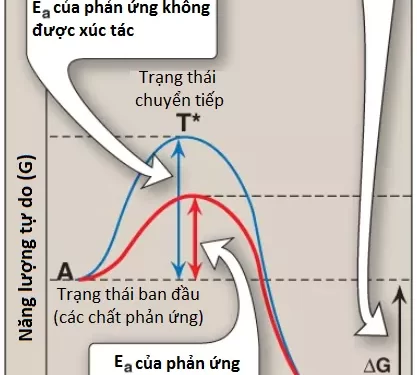
Thực tế thì tất cả các phản ứng hóa học sẽ có một rào cản năng lượng mà làm tách biệt các chất phản ứng và các sản phẩm. Rào cản năng lượng này được được gọi là năng lượng hoạt hóa (Ea), là sự chênh lệch năng lượng giữa của các chất phản ứng và một trung gian cao năng, là trạng thái chuyển tiếp (T*), được hình thành trong suốt quá trình chuyển đổi chất phản ứng thành sản phẩm. Hình 4 cho thấy các sự thay đổi về mặt năng lượng trong suốt quá trình chuyển đổi một phân tử phản ứng A thành sản phẩm B khi nó phát triển qua giai đoạn chuyển tiếp.

1. Năng lượng hoạt hóa: Đỉnh năng lượng trong Hình 4 là sự chênh lệch trong năng lượng tự do giữa chất phản ứng và T* mà trong đó trung gian cao năng, với thời gian tồn tại ngắn được hình thành trong suốt quá trình chuyển đổi của chất phản ứng thành sản phẩm. Bởi vì Ea cao nên tốc độ của các phản ứng hóa học không được xúc tác thường là chậm.
2. Tốc độ của phản ứng: Đối với các phân tử phản ứng, chúng phải chứa đủ năng lượng để có thể vượt qua rào cản năng lượng của trạng thái chuyển tiếp. Khi vắng mặt enzyme thì chỉ một lượng nhỏ các phân tử có thể sở hữu đủ năng lượng để đạt đến trạng thái chuyển tiếp giữa chất phản ứng và sản phẩm. Tốc độ của phản ứng được xác định bởi số lượng các phân tử như thế. Nhìn chung, Ea càng thấp thì càng nhiều phân tử có đủ năng lượng để vượt qua trạng thái chuyển tiếp và vì thế tốc độ phản ứng sẽ càng nhanh.
3. Con đường phản ứng thay thế: Một enzyme cho phép một phản ứng phát triển một cách nhanh chóng dưới các điều kiện đang “phổ biến” bên trong tế bào bằng cách cung cấp một con đường phản ứng thay thế với một Ea thấp hơn (xem Hình 4). Enzyme thì không làm thay đổi các năng lượng tự do của các chất phản ứng (các cơ chất) hay các sản phẩm và vì thế, không làm thay đổi cân bằng của phản ứng. Tuy nhiên, nó sẽ làm tăng tốc độ đạt đến trạng thái cân bằng.
B. Phản ứng hóa học tại vị trí hoạt động
Vị trí hoạt động thì không phải là một vị trí chứa thụ động để liên kết với cơ chất mà thay vào đó, vị trí này là một bộ máy phân tử phức tạp mà có thể thực hiện các cơ chế hóa học phong phú để tạo điều kiện cho sự chuyển đổi cơ chất thành sản phẩm. Một số yếu tố sẽ chịu trách nhiệm cho hiệu suất xúc tác của enzyme, bao gồm các ví dụ sau:
1. Sự ổn định trạng thái chuyển tiếp: Vị trí hoạt động đóng vai trò là một khung phân tử linh động kết hợp với cơ chất và khởi động sự chuyển đổi của nó thành trạng thái chuyển tiếp, một cấu trúc mà trong đó các liên kết thì không giống như trong cơ chất hay sản phẩm (xem T* ở đỉnh đường cong trong Hình 4). Bằng cách ổn định trạng thái chuyển tiếp thì enzyme sẽ làm tăng đáng kể nồng độ của trung gian phản ứng mà có thể được chuyển đổi thành sản phẩm và vì thế, giúp tăng tốc phản ứng (Chú ý: Trạng thái chuyển tiếp thì không thể được tách biệt riêng rẽ).
2. Sự xúc tác: Vị trí hoạt động có thể cung cấp các nhóm xúc tác giúp tăng cường khả năng mà trạng thái chuyển tiếp được hình thành. Trong một số enzyme, những nhóm này có thể tham gia vào trong sự xúc tác acid-base mà trong đó các gốc amino acid sẽ cung cấp hoặc nhận các protons. Trong các enzyme khác, sự xúc tác có thể liên quan đến sự hình thành tạm thời của một phức hợp cộng hóa trị ES.
Cơ chế hoạt động của chymotrypsin, một enzyme của sự tiêu hóa protein trong ruột, bao gồm sự xúc tác base, sự xúc tác acid và sự xúc tác công hóa trị. Một histidine ở vị trí hoạt động của enzyme sẽ thu (base) và mất (acid) các protons, được điều hòa bởi pK của histidine trong các protein khi gần với pH sinh lý. Serine ở vị trí hoạt động giúp hình thành nên một liên kết cộng hóa trị tạm thời với cơ chất.
3. Hình dung trạng thái chuyển tiếp: Sự chuyển đổi cơ chất được xúc tác bởi enzyme thành sản phẩm có thể được mô tả tương tự với việc cởi áo len (nhóm hóa học) khỏi một đứa trẻ không hợp tác (cơ chất) (Hình 5). Quá trình có một Ea cao bởi vì chỉ có một kế hoạch hợp lý duy nhất để cởi áo len bên ngoài của đứa trẻ đó là cần phải đưa cả hai tay qua đầu, rõ ràng là một tư thế không phù hợp thì sẽ xuất hiện khi mà không có nhân tố xúc tác. Chúng ta có thể hình dung người bố sẽ giống như là một enzyme, đầu tiên đến tiếp xúc với đứa trẻ (hình thành nên ES) và sau đó đưa các tay đứa trẻ lên ở vị trí thẳng đứng, tương tự với trạng thái chuyển tiếp. Tư thế này (sự biến đổi cấu hình) của đứa trẻ tạo điều kiện cho sự cởi áo len, từ đó, làm cho đứa trẻ được cởi áo len ra, đại diện cho sản phẩm được hình thành (Chú ý: cơ chất liên kết với enzyme [ES] thì ở năng lượng hơi thấp hơn so với cơ chất ở trạng thái không liên kết [S] và giải thích cho sự hơi lõm xuống trong đường cong tại ES).

V. Các yếu tố ảnh hưởng đến tốc độ phản ứng
Các enzymes có thể được phân tách từ các tế bào và các thuộc tính của chúng được nghiên cứu bên trong ống nghiệm (in vitro). Các enzymes khác nhau cho thấy các đáp ứng khác nhau với các sự thay đổi trong nồng độ cơ chất, nhiệt độ và pH. Phần này sẽ mô tả các yếu tố mà làm ảnh hưởng đến tốc độ phản ứng của các enzymes. Các đáp ứng của enzyme với các yếu tố này sẽ cho chúng ta các manh mối có giá trị về cách mà các enzymes thực hiện chức năng trong các tế bào sống (in vivo).
A. Nồng độ cơ chất
1. Tốc độ tối đa: Tốc độ phản ứng (V) là số lượng các phân tử cơ chất được chuyển thành sản phẩm trong mỗi đơn vị thời gian. Tốc độ thường được biểu diễn bởi đơn vị μmol sản phẩm hình thành mỗi giây. Tốc độ của phản ứng xúc tác bởi enzyme sẽ tăng theo nồng độ cơ chất cho đến khi một tốc độ tối đa được đạt đến (Vmax) (Hình 6). Sự chững lại của tốc độ phản ứng ở các nồng độ cơ chất cao phản ánh sự bão hòa với cơ chất của tất cả các vị trí liên kết sẵn có trên các phân tử enzymes.

2. Hình dạng của đường cong động học enzyme: Hầu hết các enzymes đều tuân theo động học Michaelis-Menten, trong đó một đồ thị của tốc độ phản ứng ban đầu (v0) so với nồng độ cơ chất là một đường hyperbol (tương tự như hình dạng của đường cong phân ly oxygen của myoglobin). Ngược lại, các enzyme dị lập thể không tuân theo động học Michaelis-Menten và thay vào đó là một đường cong dạng sigmoid (xem Hình 6) tương tự với hình dạng của đường cong phân ly oxygen của hemoglobin.
B. Nhiệt độ
1. Tốc phản ứng tăng theo nhiệt độ: Tốc độ phản ứng tăng lên theo nhiệt độ cho đến khi một tốc độ đỉnh được đạt đến (Hình 7). Sự tăng lên này là kết quả của sự tăng lên số lượng các phân tử cơ chất có đủ năng lượng để việc qua rào cản năng lượng và hình thành nên các sản phẩm của phản ứng.

2. Tốc độ phản ứng giảm ở nhiệt độ cao hơn: Sự tăng lên nữa của nhiệt độ gây ra một sự giảm trong tốc độ phản ứng là do sự biến tính của enzyme gây ra bởi nhiệt độ (xem Hình 7).
Nhiệt độ bình thường của cơ thể là 37oC. Nhiệt độ tối ưu đối với các enzyme người là giữa 35oC và 40oC. Các enzyme người bắt đầu biến tính ở nhiệt độ trên 40oC nhưng các vi khuẩn ưa nhiệt được tìm thấy trong các suối nước nóng có nhiệt độ tối ưu là 70oC.
C. pH
1. pH tác động lên sự ion hóa vị trí hoạt động: Nồng độ của các protons ([H+]) ảnh hưởng đến tốc độ phản ứng theo một vài cách. Đầu tiên, quá trình xúc tác thường yêu cầu enzyme và cơ chất có các nhóm hóa học đặc hiệu ở trạng thái ion hóa và không ion hóa để có được sự tương tác. Ví dụ, hoạt động xúc tác có thể yêu cầu một nhóm amino của enzyme ở trong trạng thái proton hóa (-NH3+). Bởi vì nhóm này bị deproton hóa ở pH kiềm nên tốc độ phản ứng sẽ giảm xuống.
2. pH tác động lên sự biến tính của enzyme: Các pH quá cao hoặc quá thấp cũng có thể dẫn đến sự biến tính của enzyme bởi vì cấu trúc của phân tử protein hoạt động về mặt xúc tác phụ thuộc vào đặc điểm ion hóa của các chuỗi bên amino acid.
3. Biến thiên pH tối ưu: pH mà ở đó hoạt động tối đa của enzyme sẽ đạt được thì khác nhau cho các enzyme khác nhau và thường phản ánh [H+] mà ở đó enzyme thực hiện chức năng trong cơ thể. Ví dụ, pepsin, một enzyme tiêu hóa trong dạ dày, sẽ hoạt động tối đa ở pH là 2, ngược lại các enzyme khác, vốn được sinh ra để hoạt động ở pH trung tính, thì sẽ bị biến tính bởi một môi trường acid mạnh như của dạ dày (Hình 8).

VI. Động học Michaelis-Menten
Trong một bài báo được xuất bản vào năm 1913, Leonor Michaelis và Maud Menten đã đưa ra một mô hình giải thích hầu hết các đặc điểm của nhiều phản ứng được xúc tác bởi enzyme. Trong mô hình này, enzyme kết hợp một cách thuận nghịch với cơ chất của nó để hình thành nên một phức hợp ES, thành phần này cuối cùng sẽ tạo ra sản phẩm, tái tạo lại enzyme tự do. Mô hình phản ứng, liên quan đến một phân tử cơ chất, được thể hiện ở bên dưới đây:

Trong đó:
- S là cơ chất;
- E là enzyme;
- ES là phức hợp enzyme-cơ chất;
- P là sản phẩm;
- k1, k-1 và k2 (hay kcat) là các hằng số tốc độ
A. Phương trình Michaelis-Menten
Phương trình Michaelis-Menten mô tả tốc độ phản ứng thay đổi như thế nào theo nồng độ cơ chất:

Trong đó:
- V0 = tốc độ phản ứng ban đầu;
- Vmax = tốc độ tối đa = kcat[E]Total;
- Km = hằng số Michaelis = (k-1 + k2)/k1;
- [S] = nồng độ cơ chất;
Các giả định sau đây được rút ra từ phương trình tốc độ Michaelis-Menten.
1. Các nồng độ tương đối của enzyme và cơ chất: Nồng độ cơ chất ([S]) thì lớn hơn nhiều so với nồng độ của enzyme đến nỗi phần trăm tổng lượng cơ chất được liên kết bởi enzyme ở bất kỳ một thời điểm nào thì đều nhỏ.
2. Giả định về trạng thái ổn định: Nồng độ của phức hợp ES thì không thay đổi theo thời gian (giả định trạng thái ổn định), nghĩa là tốc độ hình thành của phức hợp ES thì bằng với sự thoái hóa của ES (thành E + S và thành E + P). Nhìn chung, một trung gian trong một chuỗi các phản ứng được cho là ở trạng thái ổn định khi tốc độ tổng hợp của nó bằng với tốc độ thoái hóa của nó.
3. Tốc độ ban đầu: Tốc độ phản ứng ban đầu (V0) được sử dụng trong việc phân tích các phản ứng enzyme. Điều này có nghĩa là tốc độ của phản ứng được đo ngay khi enzyme và cơ chất được trộn lẫn vào nhau. Vào lúc đó, nồng độ sản phẩm thì sẽ rất nhỏ và vì thế, tốc độ của phản ứng nghịch đảo có thể được bỏ qua.
B. Các kết luận quan trọng
1. Các đặc điểm của Km: Km, hằng số Michaelis, là đặc trưng của một enzyme và cơ chất nhất định của nó và phản ánh ái tính của enzyme với cơ chất đó. Km bằng với nồng độ cơ chất mà ở đó tốc độ phản ứng bằng một nửa Vmax. Km thì không thay đổi theo nồng độ enzyme.
a. Km nhỏ: Một Km nhỏ phản ánh một ái tính cao của enzyme đối với cơ chất bởi vì một nồng độ cơ chất thấp cần để bán bão hòa enzyme – nghĩa là để đạt đến một tốc độ bằng một nửa Vmax (Hình 9).

b. Km lớn: Một Km lớn phản ánh ái tính thấp của enzyme đối với cơ chất bởi vì một nồng độ cơ chất cao cần để bán bão hòa enzyme.
2. Mối liên hệ của tốc độ với nồng độ enzyme: Tốc độ của phản ứng thì tỷ lệ thuận với nồng độ enzyme bởi vì [S] thì không giới hạn. Ví dụ, nếu nồng độ enzyme bị chia đôi thì tốc độ phản ứng ban đầu (V0) và Vmax bị giảm một nữa so với ban đầu.
3. Bậc của phản ứng: Khi [S] thì nhỏ hơn nhiều (<<) so với Km thì tốc độ của phản ứng gần như tỷ lệ với nồng độ cơ chất (Hình 10). Tốc độ của phản ứng sau đó được xem là hàm bậc nhất với cơ chất. Khi [S] lớn hơn nhiều (>>) so với Km thì tốc độ là một hằng số và bằng với Vmax. Tốc độ phản ứng sau đó độc lập với nồng độ cơ chất bởi vì enzyme được bão hòa với cơ chất và được cho là hàm bậc 0 với nồng độ cơ chất tương ứng (xem Hình 10).

C. Đồ thị Lineweaver-Burk
Khi V0 được thể hiện trên đồ thị so với [S] thì không phải lúc nào cũng có thể xác định khi nào mà Vmax sẽ đạt được bởi vì sự dốc lên trên dần dần của đường cong hyperbol ở các nồng độ cơ chất cao. Tuy nhiên, như Hans Lineweaver và Dean Burk mô tả lần đầu tiên vào năm 1934, nếu 1/V0 được thể hiện trên đồ thị theo 1/[S] thì chúng ta sẽ thu được một đường thẳng (Hình 11). Đồ thị này, đồ thị Lineweaver-Burk, còn được gọi là đồ thị nghịch đảo kép, có thể được sử dụng để tính toán Km và Vmax cũng như là để xác định cơ chế hoạt động của các chất ức chế enzyme.

Phương trình mô tả đồ thị Lineweaver-Burk là:

Trong đó, sự giao trên trục x thì bằng với -1/Km và sự giao trên trục y thì bằng với 1/Vmax. (Chú ý: Độ dốc = Km/Vmax).
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/cac-proteins-hinh-soi/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!