Cơ thể con người hạn chế sự tiếp cận của các phân tử lạ; do đó, để đến được mục tiêu bên trong cơ thể và có tác dụng điều trị, một phân tử thuốc phải vượt qua một số rào cản hạn chế trên con đường đến vị trí đích của nó. Sau khi dùng, thuốc phải được hấp thụ và sau đó phân phối, thường là qua các mạch (vessels) của hệ tuần hoàn và hệ bạch huyết; ngoài việc vượt qua các rào cản màng, thuốc phải tồn tại qua quá trình chuyển hóa (chủ yếu là của gan) và đào thải (qua thận và gan và trong phân). ADME, sự hấp thụ (absorption), sự phân phối (distribution), sự chuyển hóa (metabolism) và sự đào thải (elimination) thuốc, là các quá trình dược động học (Hình 2–1). Hiểu được các quá trình này và sự tương tác của chúng và sử dụng các nguyên lý dược động học làm tăng khả năng thành công của liệu pháp điều trị và giảm sự xuất hiện các tác dụng phụ của thuốc.
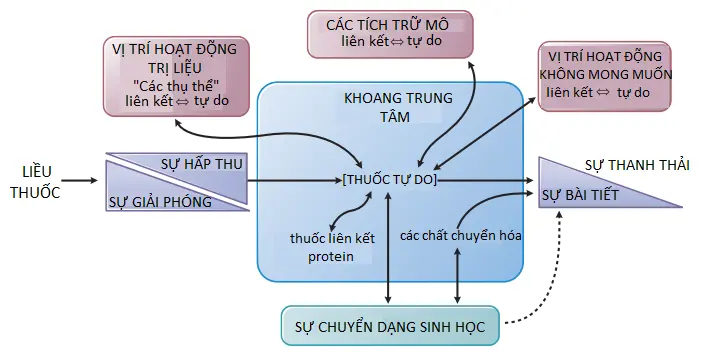
Sự hấp thụ, phân phối, chuyển hóa và bài tiết của một loại thuốc liên quan đến việc thuốc đi qua nhiều màng tế bào. Các cơ chế mà thuốc đi qua màng và các đặc tính lý hóa của các phân tử và màng mà ảnh hưởng đến quá trình vận chuyển này thì rất quan trọng để hiểu được sự phân bố của thuốc trong cơ thể con người. Các đặc điểm của thuốc mà dự đoán sự di chuyển và tính khả dụng của thuốc tại các vị trí tác động là kích thước phân tử và các đặc điểm cấu trúc, mức độ ion hóa, độ hòa tan tương đối trong lipid của các dạng ion hóa và không ion hóa, và sự liên kết của thuốc với proteins huyết thanh và mô. Mặc dù các rào cản vật lý đối với sự di chuyển của thuốc có thể là một lớp tế bào đơn lẻ (ví dụ: biểu mô ruột) hoặc nhiều lớp tế bào và các proteins ngoại bào liên quan (ví dụ: da), nhưng màng bào tương sẽ là rào cản cơ bản.
Sự đi qua các rào cản màng của thuốc
Màng bào tương có tính thấm chọn lọc
Màng bào tương bao gồm một lớp kép lipids lưỡng tính với các chuỗi hydrocarbon của chúng hướng vào bên trong đến trung tâm của lớp kép để tạo thành một pha kỵ nước liên tục, với các đầu ưa nước của chúng hướng ra ngoài. Các phân tử lipid riêng lẻ trong lớp kép thay đổi tùy theo màng cụ thể và có thể di chuyển theo chiều ngang và tự tổ chức thành các vi miền (ví dụ, các vùng có sphingolipids và cholesterol, tạo thành các bè lipid), mang lại cho màng tính lưu động (tính lỏng), tính linh hoạt, tính tổ chức, tính điện trở cao và tính không thấm tương đối đối với các phân tử có độ phân cực cao. Các proteins màng được vùi trong lớp kép đóng vai trò là các neo cấu trúc, các thụ thể, các kênh ion hay các chất vận chuyển để chuyển đổi các con đường truyền tín hiệu điện hoặc hóa học và cung cấp các mục tiêu chọn lọc cho các tác động của thuốc. Không phải là một “biển” các lipids với các proteins trôi nổi ngẫu nhiên, màng được sắp xếp và phân chia thành các phần (ngăn) (Suetsugu và cộng sự, 2014), với các thành phần giá đỡ cấu trúc liên kết vào bên trong tế bào. Các proteins màng có thể được liên kết với caveolin và cô lập trong caveolae (các hốc nhỏ), được loại khỏi caveolae hoặc được tổ chức trong các miền truyền tín hiệu giàu cholesterol và sphingolipid mà không chứa caveolin hay các proteins giá đỡ khác.
Các kiểu thấm và vận chuyển
Khuếch tán thụ động chi phối sự chuyển động xuyên màng của hầu hết các loại thuốc. Tuy nhiên, các cơ chế qua trung gian chất mang (vận chuyển chủ động và khuếch tán có gia tốc) cũng đóng các vai trò quan trọng (Hình 2-2; Hình 5-4).
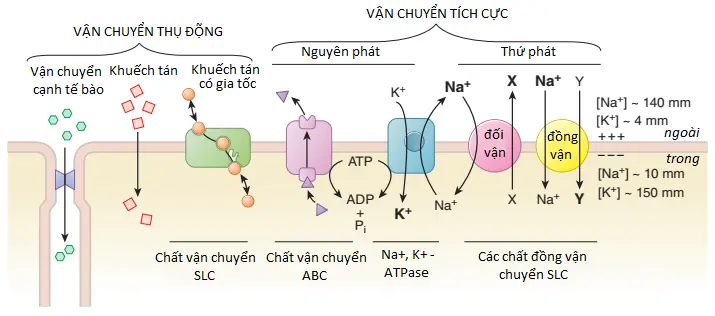
Khuếch tán thụ động
Trong vận chuyển thụ động, phân tử thuốc thường đi qua màng bằng cách khuếch tán theo một gradient nồng độ nhờ vào độ hòa tan của nó trong lớp kép lipid. Sự vận chuyển như vậy tỷ lệ thuận với độ lớn của gradient nồng độ qua màng, với hệ số phân bố lipid:nước của thuốc và với diện tích bề mặt màng tiếp xúc với thuốc. Ở trạng thái ổn định, nồng độ của thuốc không liên kết là như nhau ở cả hai bên màng nếu thuốc không phải là chất điện giải. Đối với các hợp chất ion, các nồng độ ở trạng thái ổn định phụ thuộc vào gradient điện hóa đối với ion và sự chênh lệch về độ pH qua màng mà sẽ ảnh hưởng đến trạng thái ion hóa của phân tử một cách khác nhau ở cả hai bên màng và có thể giữ thuốc bị ion hóa ở một bên màng một cách hiệu quả.
Ảnh hưởng của pH lên các thuốc có khả năng ion hóa
Nhiều loại thuốc là các acids hoặc bases yếu có mặt trong dung dịch cả dưới dạng không ion hóa mà tan trong lipid, có thể khuếch tán và dạng ion hóa mà tương đối không tan trong lipid và khuếch tán kém qua màng. Các nhóm có khả năng ion hóa phổ biến là carboxylic acids và các nhóm amino (bậc một, bậc hai và bậc ba; các amines bậc bốn giữ điện tích dương vĩnh viễn). Sự phân bố qua màng của một chất điện giải yếu bị ảnh hưởng bởi pKa của nó và gradient pH qua màng. pKa là độ pH mà tại đó một nửa thuốc (chất điện giải acid hoặc base yếu) ở dạng ion hóa. Tỷ số thuốc không ion hóa so với thuốc ion hóa ở bất kỳ độ pH nào có thể được tính toán từ phương trình Henderson-Hasselbalch:
log([dạng proton hóa]/[dạng không proton hóa]) = pKa – pH (Phương trình 2-1)
Phương trình 2-1 liên hệ giữa độ pH của môi trường xung quanh thuốc và hằng số phân ly acid của thuốc (pKa) với tỷ lệ giữa dạng proton hóa (HA hoặc BH+) và dạng không proton hóa (A− hoặc B), trong đó
HA ↔ A– + H+, trong đó Ka = [A–][H+]/[HA]
mô tả sự phân ly của một acid và
BH+ ↔ B + H+, trong đó Ka = [B][H+]/[BH+]
mô tả sự phân ly của dạng proton hóa của một bazơ.
Ở trạng thái ổn định, một loại thuốc có tính acid sẽ tích tụ ở phía có tính kiềm hơn của màng và một loại thuốc có tính kiềm ở phía có tính acid hơn. Hiện tượng này, được gọi là bẫy ion (ionic trapping), là một quá trình quan trọng trong sự phân phối thuốc có lợi ích điều trị tiềm năng (Perletti và cộng sự, 2009). Hình 2–3 minh họa hiệu ứng này và hiển thị các giá trị tính toán cho sự phân phối của một acid yếu giữa huyết tương và khoang dạ dày.

Người ta có thể tận dụng tác động của pH lên sự phân bố qua màng để thay đổi quá trình bài tiết thuốc. Trong ống thận, pH nước tiểu có thể thay đổi trong phạm vi rộng, từ 4.5 đến 8. Khi pH nước tiểu giảm (khi [H+] tăng), acid yếu (A–) và bazơ yếu (B) sẽ tồn tại ở mức độ lớn hơn ở dạng proton hóa của chúng (HA và BH+); ngược lại khi pH tăng, A– và B sẽ được ưu tiên. Vì vậy, nước tiểu kiềm có lợi cho việc bài tiết acid yếu; nước tiểu acid có lợi cho việc bài tiết base yếu. Tăng độ pH của nước tiểu (bằng cách dùng natri bicarbonate) sẽ thúc đẩy bài tiết qua nước tiểu các acid yếu như aspirin (pKa ~ 3.5) và urate (pKa ~ 5.8). Một kết quả hữu ích khác của việc thuốc bị ion hóa ở độ pH sinh lý được minh họa bằng sự thiếu tương ứng tác dụng an thần của thuốc đối kháng histamine H1 thế hệ thứ hai (ví dụ, loratadine): Thuốc kháng histamine thế hệ thứ hai là các phân tử ion hóa (ít ưa dầu, ưa nước hơn) đi qua BBB (hàng rào máu-não) kém so với các thuốc thế hệ đầu tiên như diphenhydramine, hiện được sử dụng làm thuốc hỗ trợ giấc ngủ.
Vận chuyển qua màng qua trung gian chất mang
Các proteins trong màng bào tương điều hòa cho các chuyển động xuyên màng của nhiều chất tan sinh lý; các proteins này cũng điều hòa cho các chuyển động xuyên màng của thuốc và có thể là mục tiêu tác dụng của thuốc. Vận chuyển qua trung gian được phân loại thành khuếch tán có gia tốc hoặc vận chuyển chủ động (xem Hình 2–2; Hình 5–4). Các chất vận chuyển màng và vai trò của chúng trong đáp ứng với thuốc được trình bày chi tiết trong Chương 5.
Khuếch tán có gia tốc. Khuếch tán có gia tốc là một quá trình vận chuyển qua trung gian chất mang mà trong đó động lực chỉ đơn giản là gradient điện hóa của chất tan được vận chuyển; do đó, các chất mang này có thể tạo điều kiện cho chất tan di chuyển vào hoặc ra khỏi tế bào, tùy thuộc vào hướng của gradient điện hóa. Protein mang có thể có tính chọn lọc cao đối với cấu trúc cấu hình đặc hiệu của chất tan nội sinh hoặc thuốc mà tốc độ vận chuyển của chúng bằng khuếch tán thụ động qua màng sẽ khá chậm. Ví dụ, chất vận chuyển cation hữu cơ OCT1 (SLC22A1) tạo điều kiện cho sự di chuyển của chất tan sinh lý, thiamine, và cả thuốc, bao gồm metformin, được sử dụng để điều trị bệnh tiểu đường type 2. Chương 5 mô tả OCT1 và các thành viên khác của siêu họ các chất vận chuyển SLC ở người.
Vận chuyển tích cực (chủ động). Vận chuyển tích cực được đặc trưng bởi nhu cầu năng lượng trực tiếp, khả năng di chuyển chất tan ngược với gradient điện hóa, độ bão hòa, tính chọn lọc và sự ức chế cạnh tranh bởi các hợp chất đồng vận chuyển. Na+,K+-ATPase là một ví dụ quan trọng về cơ chế vận chuyển tích cực cũng là mục tiêu điều trị của digoxin trong điều trị suy tim (Chương 29). Một nhóm các chất vận chuyển tích cực nguyên phát, họ ABC (ATP-binding cassette), thủy phân ATP để vận chuyển các cơ chất qua màng. Ví dụ, P-glycoprotein, còn được gọi là ABCB1 và MDR1 (multidrug resistance protein 1), vận chuyển các hợp chất trung tính hay cation lớn khỏi các tế bào; các cơ chất sinh lý của nó bao gồm các hormones steroid như testosterone và progesterone. MDR1 cũng vận chuyển nhiều loại thuốc, bao gồm digoxin và nhiều loại chất khác (xem Bảng 5-4). P-glycoprotein trong ruột non hạn chế sự hấp thu của một số loại thuốc uống bằng cách vận chuyển các hợp chất vào lòng ống tiêu hóa sau khi chúng được hấp thụ. Các chất vận chuyển ABC thực hiện chức năng tương tự trong các tế bào của BBB (blood-brain barrier), làm giảm hiệu quả sự tích tụ toàn phần của một số hợp chất trong não. Theo cùng cơ chế, P-glycoprotein cũng có thể gây ra khả năng kháng một số chất hóa trị liệu ung thư (xem Chương 65–68).Các thành viên của siêu họ SLC (solute carrier) có thể làm trung gian cho quá trình vận chuyển tích cực thứ phát bằng cách sử dụng năng lượng điện hóa được tích trữ trong một gradient (thường là Na+) để chuyển cả chất tan sinh học và thuốc qua màng. Ví dụ, protein trao đổi Na+-Ca2+ (SLC8) sử dụng năng lượng được tích trữ trong gradient Na+ được thiết lập bởi Na+,K+-ATPase để bài xuất Ca2+ trong tế bào chất và duy trì nó ở mức cơ bản thấp, khoảng 100 nM trong hầu hết các tế bào. Do đó, SLC8 là một chất đối vận, sử dụng dòng Na+ vào bên trong để thúc đẩy dòng Ca2+ ra ngoài; SLC8 cũng giúp điều hòa các tác dụng “positive inotropic” (tăng co bóp cơ tim) của digoxin và các glycosides tim khác mà ức chế hoạt động của Na+, K+-ATPase và do đó làm giảm lực động lực đẩy Ca2+ ra khỏi tế bào cơ tim tâm thất. Các chất đồng vận chuyển SLC khác là các chất đồng vận, trong đó thúc đẩy ion và chất tan di chuyển theo cùng một hướng. CNT1 (concentrative nucleoside transporter 1) (SLC28A1), được thúc đẩy bởi gradient Na+, di chuyển các pyrimidine nucleosides và các chất hóa trị liệu ung thư gemcitabine và cytarabine vào tế bào. DAT, NET và SERT, các chất vận chuyển lần lượt cho các chất dẫn truyền thần kinh dopamine, norepinephrine và serotonin, là các chất vận chuyển tích cực thứ phát cũng dựa vào năng lượng được lưu trữ trong gradient Na+ xuyên màng, các chất đồng vận mà phối hợp chuyển động của Na+ và chất dẫn truyền thần kinh theo cùng một hướng (vào tế bào thần kinh); chúng cũng là mục tiêu của các tác nhân hoạt động CNS (central nervous system) được sử dụng trong liệu pháp điều trị trầm cảm. Các thành viên của siêu họ SLC hoạt động trong sự vận chuyển thuốc ở đường tiêu hóa, gan và thận và nhiều vị trí khác.
Vận chuyển cạnh tế bào
Trong khoang mạch, sự di chuyển cạnh tế bào của các chất tan và dịch qua các khoảng hở giữa các tế bào là đủ lớn cho sự vận chuyển thụ động qua nội mô của các mao mạch và các tiểu tĩnh mạch sau mao mạch thường bị hạn chế bởi lưu lượng máu. Các mao mạch của hệ thần kinh trung ương và nhiều mô biểu mô có các mối nối chặt hạn chế sự di chuyển cạnh tế bào của thuốc (Spector và cộng sự, 2015).
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/61550892771585/
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/duoc-dong-hoc-pharmacokinetics-phan-4/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!




































