V. Sự thoái hóa của nucleotide purine
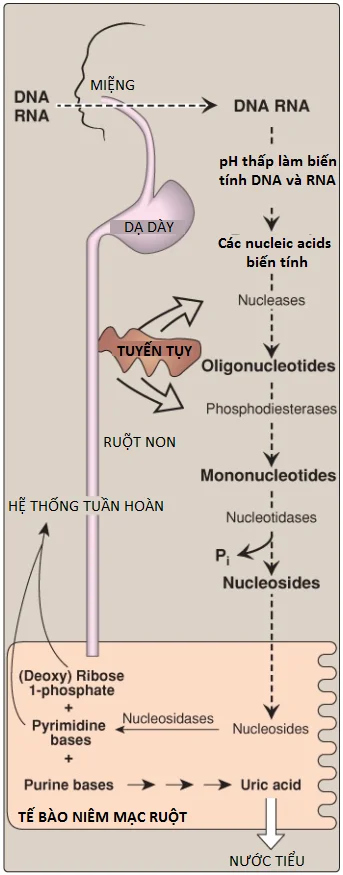
Sự thoái hóa của nucleic acids chế độ ăn xảy ra trong ruột non, nơi mà các nucleases của tụy thủy phân chúng thành các nucleotides. Các nucleotides được thoái hóa một cách tuần tự bởi các enzymes ruột thành các nucleosides, các đường phosphoryl hóa và các bases tự do. Uric acid là sản phẩm cuối cùng của sự thoái hóa purine của ruột. (Chú ý: Các nucleotides purine từ sự tổng hợp mới được thoái hóa trong gan là chủ yếu. Các bases tự do được đưa ra khỏi gan và được thu hồi bởi các mô ngoại vi).
A. Sự thoái hóa trong ruột non
Các ribonucleases và deoxyribonucleases, được bài tiết bởi tuyến tụy, thủy phân RNA và DNA trong chế độ ăn thành các oligonucleotides mà được thủy phân thêm bởi phosphodiesterases của tụy, tạo thành một hỗn hợp của 3’- và 5’-mononucleotides. Ở bề mặt niêm mạc ruột, các nucleotidases loại bỏ các nhóm phopshate bằng cách thủy phân, giải phóng các nucleosides mà được hấp thu vào trong các tế bào niêm mạc ruột bởi các kênh vận chuyển phụ thuộc natri và thoái hóa bởi nucleosidases (nucleotide phosphorylases) thành các bases tự do cùng với (deoxy) ribose 1-phosphate. Các bases purine trong chế độ ăn thì không được sử dụng với mức độ đáng kể cho sự tổng hợp nucleic acids mô. Thay vào đó, chúng được thoái hóa thành uric acid trong các tế bào niêm mạc ruột. Hầu hết uric acid đi vào trong máu và cuối cùng được bài tiết trong nước tiểu. Một sự tóm tắt của con đường này được thể hiện trong Hình 14. (Chú ý: Các động vật có vú ngoài linh trưởng biểu hiện urate oxidase [uricase], mà phân tách vòng purine, tạo thành allantoin. Urate oxidase tái tổ hợp bây giờ được sử dụng trên lâm sàng để làm giảm các mức urate).
B. Sự hình thành của uric acid
Mọt sự tóm tắt các bước trong quá trình tạo thành của uric acid và các bệnh di truyền liên quan với các sự thiếu hụt của các enzymes thoái hóa đặc hiệu được thể hiện trong Hình 15. (Chú ý: Các số trong các ngoặc vuông đề cập đến các phản ứng chuyên biệt trong hình).
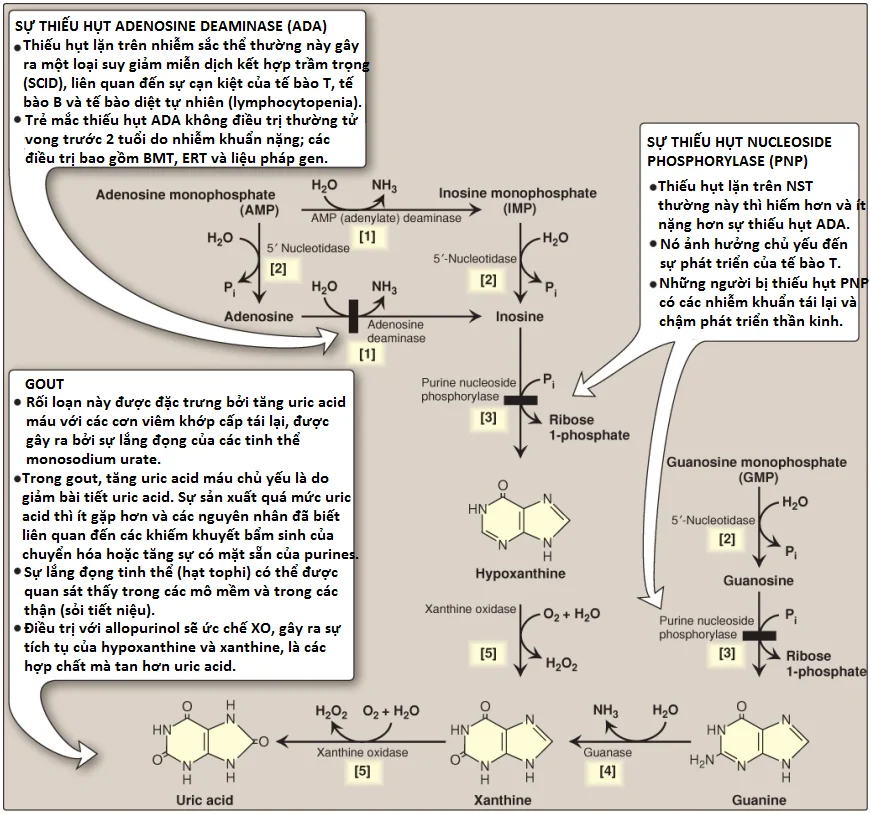
1. Một nhóm amino được loại bỏ khỏi AMP để tạo thành IMP bởi AMP (adenylate) deaminase hoặc khỏi adenosine để tạo thành inosine (hypoxanthine-ribose) bởi ADA.
2. IMP và GMP được chuyển thành các dạng nucleoside tương ứng của chúng, inosine và guanosine, bởi hoạt động của 5’-nucleotidase.
3. Purine nucleoside phosphorylase chuyển inosine và guanosine thành các bases purine tương ứng của chúng, hypoxanthine và G. (Chú ý: Một mutase chuyển đổi qua lại giữa ribose 1- và ribose 5-phosphate).
4. G được khử amino để hình thành nên xanthine.
5. Hypoxanthine được oxy hóa bởi xanthine oxidase (XO) chứa molybdenum thành xanthine, chất mà được oxy hóa nhiều hơn nữa bởi XO thành uric acid, sản phẩm cuối cùng của thoái hóa purine người. Uric acid được bài tiết chủ yếu trong nước tiểu.
C. Các bệnh liên quan với sự thoái hóa purine
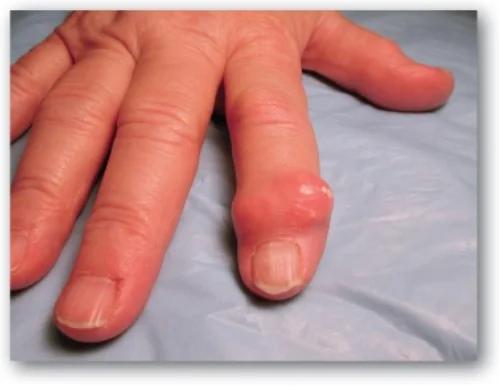
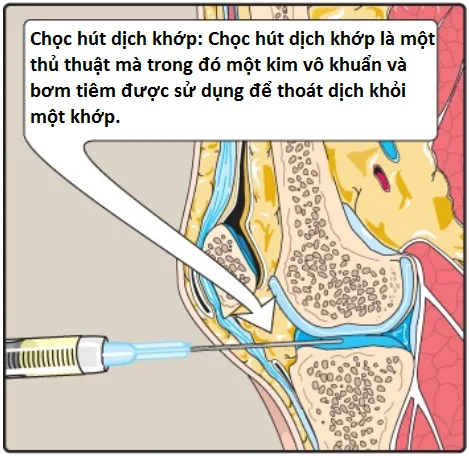
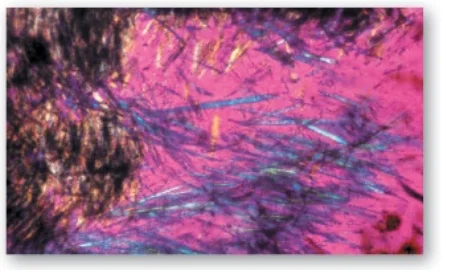
1. Gout: Gout là một rối loạn được khởi động bởi các mức cao uric acid (sản phẩm cuối cùng của sự dị hóa purine) trong máu (tăng uric acid máu), kết quả của sự quá sản xuất hoặc sự giảm bài tiết uric acid. Tăng uric acid máu có thể dẫn đến sự tích tụ của các tinh thể monosodium urate (MSU) trong các khớp và một đáp ứng viêm đối với các tinh thể, gây ra viêm khớp do gout đầu tiên là cấp tính và sau đó tiến triển đến mạn tính. Các khối dạng nốt của các tinh thể MSU (các hạt tophi) có thể lắng đọng trong các mô mềm, gây ra bệnh gout mạn tính có hạt tophi (tophaceous gout) (Hình 16). Sự hình thành của các sỏi uric acid trong thận (sỏi tiết niệu) cũng có thể được phát hiện thấy. (Chú ý: Tăng uric acid máu thì không đủ để gây ra bệnh gout, nhưng bệnh gout luôn luôn được báo trước bởi sự tăng uric acid máu. Tăng uric acid máu thường không có triệu chứng nhưng có thể là chỉ điểm cho các tình trạng bệnh tật như tăng huyết áp). Chẩn đoán xác định gout cần sinh thiết và kiểm tra hoạt dịch (Hình 17) từ một khớp bị ảnh hưởng (hoặc thành phần từ một hạt tophi) sử dụng kính hiển vi quang học phân cực để xác nhận sự có mặt của các tinh thể MSU hình kim (Hình 18).
a. Sự giảm bài tiết uric acid: Ở >90% những người mắc tăng uric acid máu, nguyên nhân là giảm bài tiết uric acid. Giảm bài tiết có thể là nguyên phát, do các khiếm khuyết bài tiết di truyền cho đến bây giờ vẫn chưa xác định được hoặc thứ phát sau các quá trình bệnh lý đã biết mà ảnh hưởng đến cách mà thận xử lý urate (như trong nhiễm toan lactic, lactate làm tăng sự tái hấp thu urate của ống thận, bằng cách đó, làm giảm sự bài tiết của chúng) và thứ phát sau các yếu tố môi trường như việc sử dụng các thuốc (như các thuốc lợi niệu thiazide) hoặc phơi nhiễm chì (gout do nhiễm độc chì [saturnine gout]).
b. Sự sản xuất quá mức uric acid: Một nguyên nhân ít gặp hơn của tăng uric acid máu là từ sự sản xuất quá mức uric acid. Tăng uric acid máu nguyên phát đa phần là vô căn (idiopathic) (không biết nguyên nhân). Tuy nhiên, một số đột biến đã được xác định trong gen của PRPP synthetase liên kết NST X tạo ra enzyme có một vận tốc tối đa tăng lên (Vmax) đối với sự sản xuất PRPP, một Km thấp hơn đối với ribose 5-phosphate, hay một độ nhạy cảm giảm với purine nucleotides, các chất ức chế dị lập thể của nó. Trong mỗi trường hợp, tăng sự có mặt sẵn của PRPP sẽ làm tăng sự sản xuất purine, tạo ra các mức tăng của uric acid huyết tương. Hội chứng Lesch-Nyhan cũng gây ra tăng uric acid máu do giảm sự thu hồi của hypoxanthine và G và các sự có mặt sẵn tăng lên kế tiếp của PRPP. Tăng uric acid máu thứ phát thường là kết cục của việc tăng sự có mặt sẵn của purines (như ở các bệnh nhân mà mắc các rối loạn tăng sinh tủy [myeloproliferative disorders] hoặc những người mà trải qua hóa trị và vì thế có một tốc độ thay thế tế bào cao). Tăng uric acid máu cũng có thể là kết quả của các bệnh chuyển hóa dường như không liên quan, như bệnh Gierke hoặc không dung nạp fructose di truyền.
c. Điều trị: Các đợt cấp của gout được điều trị với các thuốc chống viêm. Colchicine, các thuốc steroid như prednisone và các thuốc không steroid như indomethacin được sử dụng. (Chú ý: Colchicine ngăn cản sự hình thành của các vi ống, bằng cách đó, làm giảm sự vận động của bạch cầu trung tính vào trong vùng bị ảnh hưởng. Giống như các thuốc kháng viêm khác, nó không có tác động lên các mức uric acid). Các chiến lược điều trị lâu dài đối với gout liên quan đến việc làm hạ mức uric acid bên dưới điểm bão hòa của nó (6.5 mg/dl), bằng cách đó, ngăn chặn sự lắng đọng của các tình thể MSU. Các thuốc tăng đào thải uric acid (uricosuric agents) như probenecid hoặc sulfinpyrazone mà làm tăng sự bài tiết uric acid của thận, được sử dụng ở các bệnh nhân mà bị giảm bài tiết uric acid. Allopurinol, một chất tương tự về mặt cấu trúc của hypoxanthine, ức chế sự tổng hợp uric acid và được sử dụng ở những bệnh nhân mà sản xuất quá mức uric acid. Allopurinol được oxy hóa thành oxypurinol, một chất ức chế tồn tại lâu của XO. Điều này gây ra sự tích tụ của hypoxanthine và xanthine (xem Hình 15), các hợp chất tan nhiều hơn uric acid và vì thế, ít có khả năng khởi động một đáp ứng viêm. Ở những bệnh nhân có các mức HGPRT bình thường, hypoxanthine có thể được thu hồi, làm giảm các mức PRPP và vì thế, giảm sự tổng hợp purine mới. Febuxostat, một chất ức chế không phải purine của XO thì cũng có thể được sử dụng. (Chú ý: Các mức uric acid trong máu bình thường thì gần với điểm bão hòa. Một nguyên nhân cho điều này có thể là các tác động chống oxy hóa mạnh của uric acid).
2. Sự thiếu hụt adenosine deaminase: ADA được biểu hiện trong nhiều mô nhưng ở người, các tế bào lympho có hoạt động cao nhất của enzyme bào tương này. Một sự thiếu hụt ADA gây ra sự tích tụ của adenosine, là thành phần được chuyển thành các dạng ribonucleotide hoặc deoxyribonucleotide bởi các kinases tế bào. Khi các mức dATP tăng lên, ribonucleotide reductase bị ức chế, bằng cách đó, ngăn cản sự sản xuất của tất cả các nucleotides chứa deoxyribose. Kết quả, các tế bào không thể tạo DNA và phân chia. (Chú ý: dATP và adenosine mà tích tụ trong tình trạng thiếu hụt ADA dẫn đến sự ngừng phát triển và sự chết theo chương trình của các lympho bào). Trong dạng nghiêm trọng nhất, rối loạn lặn trên NST thường này gây ra một loại bệnh suy giảm miễn dịch kết hợp nghiêm trọng (severe combined immunodeficiency disease – SCID), liên quan đến một sự giảm trong các tế bào T, các tế bào B và các tế bào diệt tự nhiên. Sự thiếu hụt ADA chiếm khoảng 14% các trường hợp SCID ở Hoa Kỳ. Các điều trị bao gồm cấy ghép tủy xương, liệu pháp thay thế enzyme và liệu pháp gene. Nếu như không có điều trị thích hợp, những đứa trẻ mắc rối loạn này thường chết do nhiễm khuẩn ở khoảng 2 tuổi. (Chú ý: Sự thiếu hụt purine nucleoside phosphorylase gây ra một suy giảm miễn dịch ít nghiêm trọng hơn chủ yếu liên quan đến các tế bào T).
VI. Sự tổng hợp và thoái hóa pyrimidine
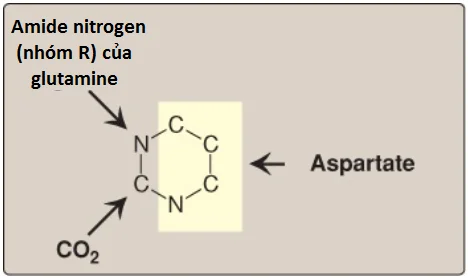
Không giống như sự tổng hợp vòng purine, là thành phần được cấu trúc trên một ribose 5-phosphate tồn tại trước đó, vòng pyrimidine được tổng hợp trước khi được nối với ribose 5-phosphate, là thành phần được cho bởi PRPP. Các nguồn của các nguyên tử trong vòng pyrimidine là glutamine, CO2 và aspartate (Hình 19).
A. Sự tổng hợp carbamoyl phosphate
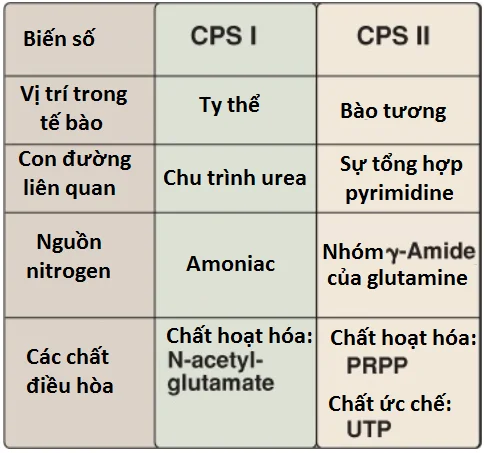
Bước điều hòa của con đường này ở các tế bào động vật có vú là sự tổng hợp của carbamoyl phosphate từ glutamine và CO2, được xúc tác bởi carbamoyl phosphate synthetase (CPS) II. CPS II bị ức chế bởi uridine triphosphate (UTP, sản phẩm cuối cùng của con đường này, mà được chuyển thành các nucleotides pyrimidine khác) và được hoạt hóa bởi PRPP. (Chú ý: Carbamoyl phosphate, được tổng hợp bởi CPS I, cũng là một tiền thân của urea. Các khiếm khuyết trong ornithine transcarbamylase [OTC] của chu trình urea làm tăng cường sự tổng hợp pyrimidine do tăng sự có sẵn của carbamoyl phosphate. Một sự so sánh của hai enzyme được thể hiện trong Hình 20).
B. Sự tổng hợp của orotic acid
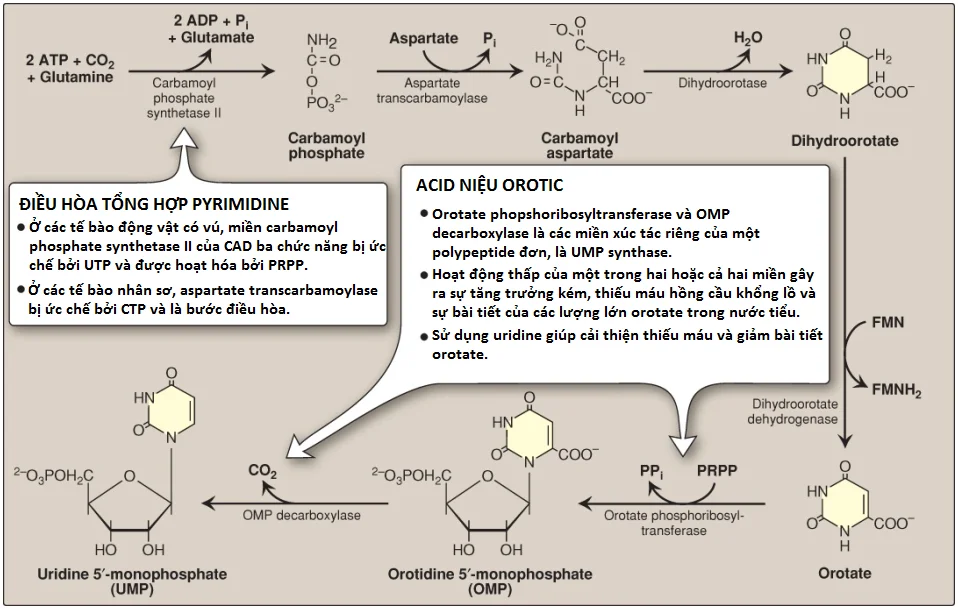
Bước thứ hai trong sự tổng hợp pyrimidine là sự hình thành của carbamoylaspartate, được xúc tác bởi aspartate transcarbamoylase. Vòng pyrimidine sau đó được đóng bởi dihydroorotase. Dihydroorotate tạo thành được oxy hóa để tạo ra orotic acid (orotate), như được thể hiện trong Hình 21. Flavin mononucleotide (FMN) được khử trong phản ứng này.
C. Sự tổng hợp pyrimidine nucleotide
Vòng pyrimidine hoàn thiện được chuyển thành nucleotide orotidine monophosphate (OMP) trong giai đoạn thứ hai của sự tổng hợp pyrimidine nucleotide (xem Hình 21). Như được quan sát thấy với purines, PRPP là chất cho ribose 5-phosphate. Enzyme orotate phosphoribosyltransferase tạo ra OMP và giải phóng pyrophosphate, bằng cách đó, khiến cho phản ứng không thể đảo ngược về mặt sinh học. (Chú ý: Cả sự tổng hợp purine và pyrimidine đều cần glutamine, aspartic acid và PRPP như là các tiền thân thiết yếu). OMP (orotidylate) được decarboxyl hóa thành uridine monophosphate (UMP) bởi orotidylate decarboxylase. Các hoạt động của phosphoribosyltransferase và decarboxylase là các miền xúc tác riêng biệt của một polypeptide đơn được gọi là UMP synthase. Nhiễm acid niệu orotic di truyền (một rối loạn rất hiếm gặp) có thể được gây ra bởi một sự thiếu hụt của một hoặc cả hai hoạt động của enzyme hai chức năng này, làm cho orotic acid xuất hiện trong nước tiểu (xem Hình 21). Bởi vì phản ứng đầu tiên của sinh tổng hợp pyrimidine được ức chế phản hồi bởi UTP, nên nhiễm acid niệu orotic di truyền và thiếu máu liên quan được điều trị với uridine. Nhớ lại rằng một sự thiếu hụt của OTC trong chu trình urea sẽ biểu hiện các mức orotate tăng lên trong nước tiểu. Điều này là bởi vì cơ chất carbamoyl phosphate của OTC được hướng đến sự tổng hợp pyrimidine. UMP được phosphoryl hóa kế tiếp thành UDP và UTP. (Chú ý: UDP là một cơ chất cho ribonucleotide reductase, là enzyme tạo ra dUDP. dUDP được phosphoryl hóa thành dUTP, là thành phần mà được thủy phân nhanh thành dUMP bởi UTP diphosphatase [dUTPase]. Vì thế, dUTPase đóng một vai trò quan trọng trong việc làm giảm sự có mặt sẵn của dUTP như là một cơ chất cho sự tổng hợp DNA, bằng cách đó, ngăn cản sự tích hợp không đúng của U vào trong DNA).
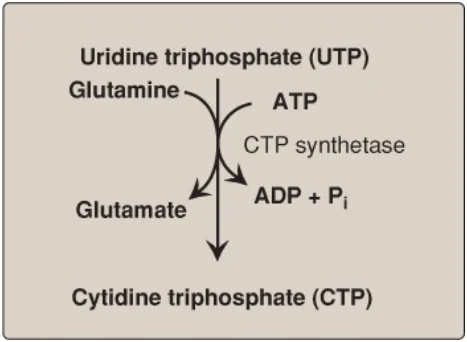
D. Sự tổng hợp cytidine triphosphate
Cytidine triphosphate (CTP) được sản xuất bởi sự amino hóa của UTP bởi CTP synthetase (Hình 22), với glutamine giúp cung cấp nitrogen. Một số CTP này được dephosphoryl hóa thành CDP, là cơ chất cho ribonucleotide reductase. Sản phẩm dCDP có thể được phopshoryl hóa thành dCTP cho sự tổng hợp DNA hoặc dephosphoryl hóa thành dCMP mà được khử amino thành dUMP.
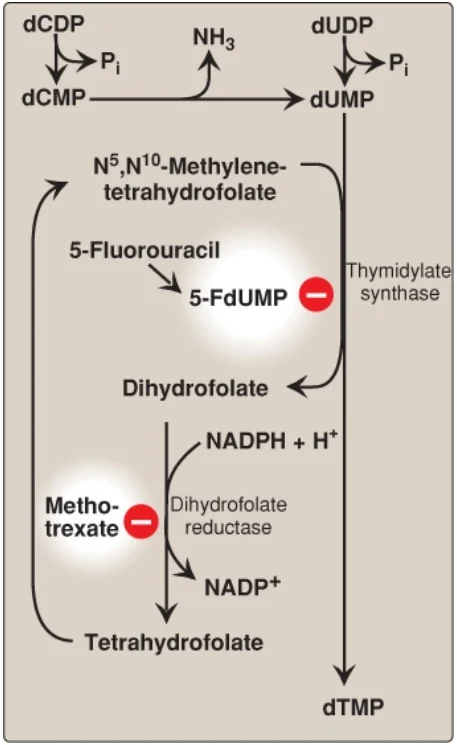
E. Sự tổng hợp deoxythymidine monophosphate
dUMP được chuyển thành deoxythymidine monophosphate (dTMP) bởi thymidine synthase, là enzyme sử dụng N5, N10-methylene-THF như là một nguồn của nhóm methyl. Đây là phản ứng không thường gặp mà trong đó THF đóng góp không chỉ một đơn vị một carbon mà còn hai nguyên tử hydrogen từ vòng pteridine, gây ra sự oxy hóa của THF thành dihydrofolate ([DHF], Hình 23). Các chất ức chế của thymidylate synthase bao gồm các chất tương tự T như 5-fluorouracil, mà đóng vai trò như là các chất chống khối u. 5-Fluorouracil được chuyển đổi về mặt chuyển hóa thành 5-fluorodeoxyuridine monophosphate (5-FdUMP), là thành phần trở nên liên kết vĩnh viễn với thymidylate synthase bất hoạt, khiến cho thuốc trở thành một “chất ức chế tự sát” (suicide inhibitor). DHF có thể được khử thành THF bởi DHF reductase, một enzyme mà được ức chế bởi các chất tương tự folate như methotrexate. Bằng cách làm giảm sự cung cấp THF, các thuốc này không chỉ ức chế sự tổng hợp purine (xem Hình 7, phần 1), mà còn bằng cách ngăn cản sự methyl hóa của dUMP thành dTMP, chúng cũng làm giảm sự có mặt sẵn của thành phần thiết yếu của DNA này. Sự tổng hợp DNA bị ức chế và sự tăng trưởng tế bào chậm lại. Vì thế, các thuốc này được sử dụng để điều trị ung thư. (Chú ý: Acyclovir [một chất tương tự purine] và 3′-azido-3′-deoxythymidine [AZT, một chất tương tự pyrimidine] lần lượt được sử dụng để điều trị các nhiễm virus herpes simplex và virus suy giảm miễn dịch người. Mỗi trong số đó ức chế DNA polymerase của virus).
F. Sự thu hồi và sự thoái hóa pyrimidine
Không giống như vòng purine, mà không được phân tách ở người và được bài tiết dưới dạng uric acid hòa tan kém, vòng pyrimidine thì được mở và thoái hóa thành các sản phẩm có khả năng hòa tan cao, β-alanine (từ sự thoái hóa của CMP và UMP) và β-aminosobutyrate (từ sự thoái hóa TMP), với sự tạo ra của amoniac và CO2. Các bases pyrimidine có thể được thu hồi thành các nucleosides mà được phosphoryl hóa thành các nucleotides. Tuy nhiên, tính tan cao của chúng khiến cho sự thu hồi pyrimidine ít ý nghĩa về mặt lâm sàng hơn so với sự thu hồi purine. (Chú ý: Sự thu hồi của pyrimidine nucleosides là cơ sở cho việc sử dụng uridine trong điều trị nhiễm acid niệu orotic di truyền).
VII. Tóm tắt loạt bài viết
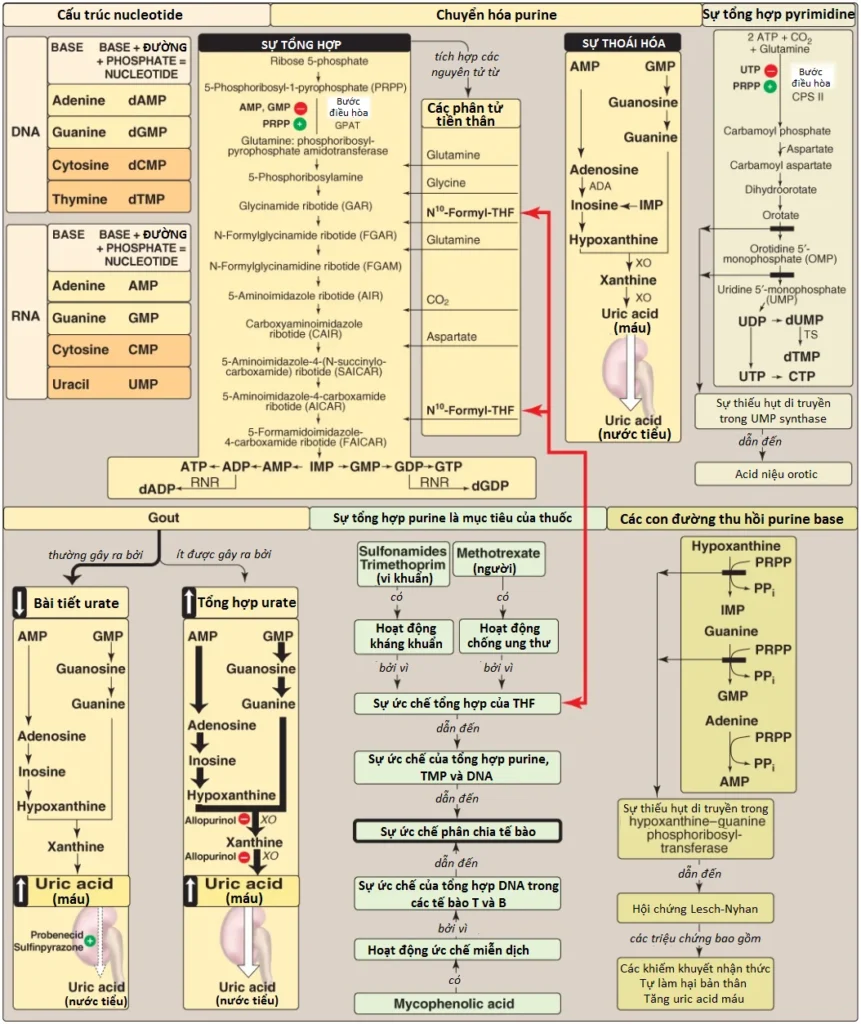
- Nucleotides bao gồm một base nitrogen (A, G, C, U và T); một đường pentose; và một, hai, hoặc ba nhóm phosphate (Hình 24).
- A và G là các purines và C, U, T là các pyrimidines.
- Nếu như đường là ribose, nucleotide là một ribonucleoside phosphate (như AMP), và nó có thể có một số chức năng trong tế bào, bao gồm cả việc là một thành phần của RNA. Nếu như đường là deoxyribose, nucleotide là một deoxyribonucleoside phosphate (như deoxyAMP) và sẽ được tìm thấy gần như hoàn toàn là một thành phần của DNA.
- Bước cam kết trong sự tổng hợp purine sử dụng PRPP (một pentose hoạt hóa mà cung cấp ribose 5-phosphate cho sự tổng hợp mới và sự thu hồi purine và pyrimidine) và nitrogen từ glutamine để tạo ra phosphoribosylamine. Enzyme là GPAT và được ức chế bởi AMP và GMP (các sản phẩm cuối cùng của con đường) và được hoạt hóa bởi PRPP.
- Các nucleotides purine cũng có thể được sản xuất từ các bases purine được hình thành trước bằng cách sử dụng các phản ứng thu hồi được xúc tác bởi APRT và HGPRT. Một sự thiếu hụt gần như hoàn toàn của HGPRT gây ra hội chứng Lesch-Nyhan, một dạng di truyền nghiêm trọng của tăng uric acid máu kèm theo bởi rối loạn tự làm hại bản thân cưỡng chế (compulsive self-mutilation).
- Tất cả các deoxyribonucleotides được tổng hợp từ ribonucleotides bởi enzyme ribonucleotide reductase. Enzyme này thì được điều hòa mạnh (ví dụ, nó bị ức chế mạnh bởi dATP, một hợp chất mà được sản xuất quá mức trong các tế bào tủy xương ở những người mà mắc sự thiếu hụt ADA). Sự thiếu hụt ADA gây ra SCID.
- Sản phẩm cuối cùng của sự thoái hóa purine là uric acid, một hợp chất có tính hòa tan thấp mà sự sản xuất quá mức hoặc sự giảm bài tiết của nó gây ra tăng uric acid máu mà nếu như được kèm theo bởi sự lắng đọng của các tinh thể MSU trong các khớp và các mô mềm và một đáp ưng viêm đối với các tinh thể đó thì sẽ gây ra gout.
- Bước đầu tiền trong sự tổng hợp pyrimidine, sự sản xuất của carbamoyl phosphate bởi CPS II, là bước điều hòa trong con đường này (nó bị ức chế bởi UTP và hoạt hóa bởi PRPP). UTP tạo ra bởi con đường này có thể được chuyển thành CTP.
- Deoxyuridine monophosphate có thể được chuyển thành dTMP bởi thymidylate synthase, một enzyme mà được hướng đến bởi các thuốc chống ung thư như 5-fluorouracil.
- Sự tái tạo của tetrahydrofolate từ DHF mà được tạo thành trong phản ứng thymidine synthase thì cần đến dihydrofolate reductase, một enzyme được hướng đến bởi thuốc methotrexate.
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/chuyen-hoa-nucleotide-phan-1/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!





































