VI. Lipoproteins huyết tương
D. Chuyển hóa lipoprotein mật độ thấp
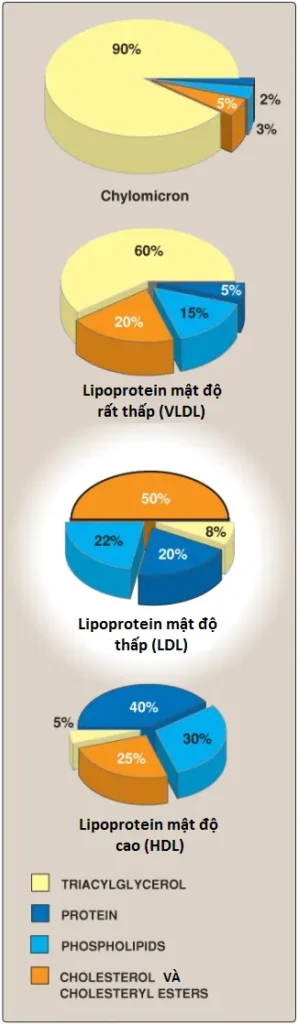
Các phần tử LDL chứa TAG thấp hơn nhiều so với các tiền thân VLDL của chúng và có một nồng độ cao cholesterol và cholesteryl esters (Hình 20). Khoảng 70% cholesterol huyết tương là ở trong LDL.
1. Sự nhập bào qua trung gian thụ cảm thể: Chức năng chủ yếu của các phần tử LDL là cung cấp cholesterol đến các mô ngoại vi (hoặc đưa nó trở về gan). Chúng làm việc này bằng cách liên kết với các thụ cảm thể LDL màng bào tương mà nhận diện apo B-100 (mà không phải là apo B-48). Bởi vì các thụ cảm thể LDL này cũng có thể liên kết apo E nên chúng được gọi là các thụ cảm thể apo B-100/apo E. Một sự tóm tắt về sự hấp thu và thoái hóa của các phần tử LDL được thể hiện trong Hình 21. (Chú ý: Các số trong các ngoặc vuông bên dưới đề cập đến các số tương ứng trong hình). Một cơ chế tương tự của sự nhập bào qua trung gian thụ cảm thể được sử dụng để hấp thu và thoái hóa các phần thừa chylomicrons và IDLs bởi gan.
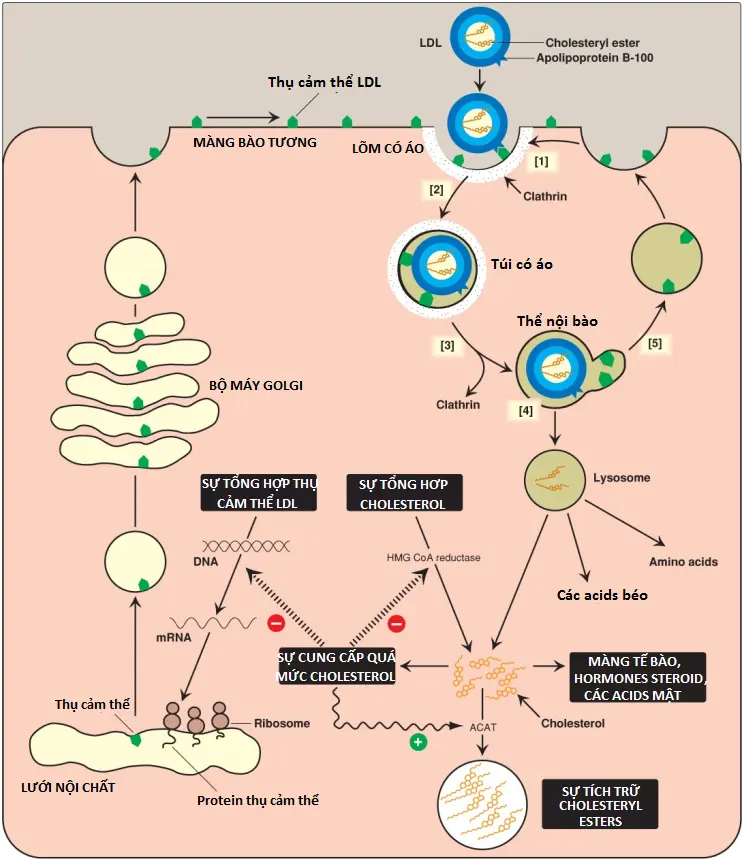
[1] Các thụ cảm thể LDL là các glycoproteins tích điện âm mà kết tập trong lõm (pits) trên các màng tế bào. Phía bào tương của lõm được bao lấy bởi protein clathrin, thành phần giúp ổn định lõm.
[2] Sau khi liên kết, phức hợp LDL – thụ cảm thể được nhập bào. (Chú ý: Các khiếm khuyết trong sự tổng hợp của các thụ cảm thể LDL chức năng gây ra một sự tăng lên đáng kể trong LDL-C huyết tương. Những bệnh nhân có các sự thiếu hụt như vậy sẽ mắc tăng lipid máu type IIa [tăng cholesterol máu có tính chất gia đình [FH] và xơ vữa động mạch sớm. Tăng cholesterol máu do đột biến gene trội trên NST thường cũng có thể được gây ra bởi các khiếm khuyết trong apo B-100 mà làm giảm sự liên kết của nó với thụ cảm thể và bởi sự tăng hoạt động của một protease, proprotein convertase subtilisin/kexin type 9 [PCSK9], làm tăng cường sự nội hóa và sự thoái hóa lysosome của thụ cảm thể. Các chất ức chế PCSK9 bây giờ đã có sẵn cho việc điều trị tăng cholesterol máu).
[3] Túi chứa LDL mất lớp áo clathrin của nó và hợp với các túi tương tự khác, hình thành nên các túi lớn hơn được gọi là các thể nội bào (endosomes).
[4] pH của thể nội bào giảm (do hoạt động bơm proton của ATPase thể nội bào [endosomal ATPase]), điều này cho phép sự phân tách của LDL khỏi thụ cảm thể của nó. Các thụ cảm thể sau đó di chuyển đến một phía của thể nội bào, ngược lại, LDL nằm tự do ở bên trong lòng túi.
[5] Các thụ cảm thể có thể được tái chế, ngược lại, các phần thừa lipoprotein (lipoprotein remnants) trong túi thì được chuyển đến các lysosomes và bị thoái hóa bởi các acid hydrolases của lysosome, giải phóng cholesterol tự do, các amino acids, các acid béo và phospholipids. Các hợp chất này có thể được tái sử dụng bởi tế bào. (Chú ý: Một số bệnh tích trữ lysosome là do các sự suy giảm di truyền lặn trên nhiễm sắc thể thường hiếm trong khả năng thủy phần các cholesteryl esters của lysosome [bệnh Wolman] hoặc vận chuyển cholesterol tự do ra khỏi lysosome [bệnh Niemann-Pick, type C]).
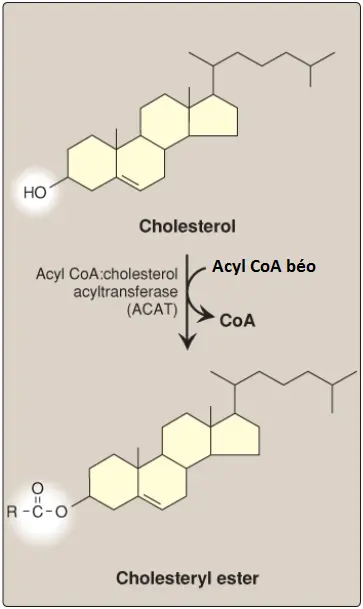
2. Cholesterol được nhập bào và sự cân bằng nội môi cholesterol: Cholesterol của phần thừa chylomicron, và cholesterol có nguồn gốc từ IDL và LDL ảnh hưởng đến hàm lượng cholesterol tế bào theo một số cách (Hình 21). Đầu tiên, sự biểu hiện của gene HMG CoA reductase bị ức chế bởi mức cholesterol cao và kết quả là sự tổng hợp cholesterol mới giảm. Ngoài ra, sự thoái hóa của reductase cũng được tăng cường. Thứ hai, sự tổng hợp mới của protein thụ cảm thể LDL bị giảm bởi sự giảm biểu hiện của gene thụ cảm thể LDL, vì thế, giới hạn sự đi vào thêm của LDL-C vào trong các tế bào. (Chú ý: Như được quan sát thấy với gene reductase, sự điều hòa phiên mã của gene thụ cảm thể LDL liên quan với một SRE và SREBP-2. Điều này cho phép sự phối hợp điều hòa biểu hiện của các proteins này). Thứ ba, nếu như cholesterol không cần ngay cho một số mục đích cấu trúc và tổng hợp thì nó sẽ được ester hóa bởi acyl CoA: cholesterol acyltransferase (ACAT). ACAT chuyển một acid béo từ một acyl CoA béo (fatty acyl CoA) đến cholesterol, tạo thành một cholesteryl ester mà có thể được tích trữ trong tế bào (Hình 22). Hoạt động của ACAT được tăng cường khi sự có mặt của cholesterol nội bào tăng lên.
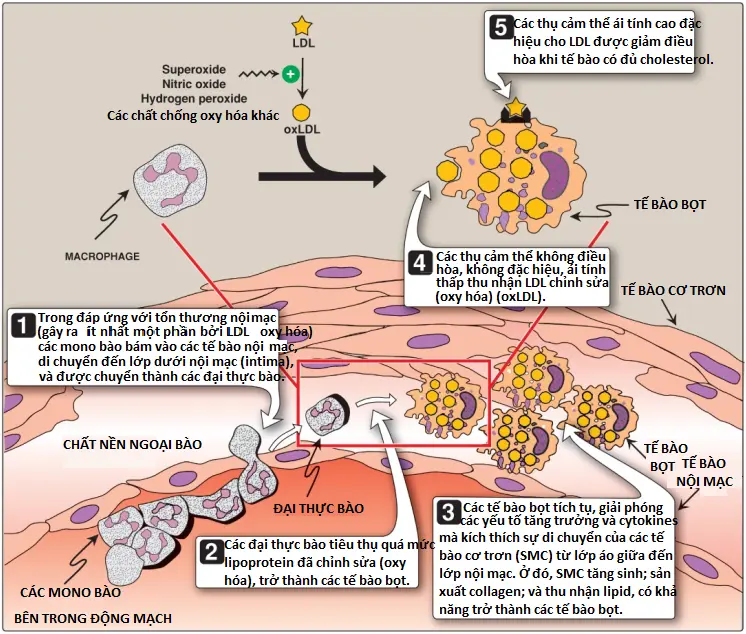
3. Sự hấp thu bởi các thụ cảm thể dọn dẹp của đại thực bào (macrophage scavenger receptors): Ngoài con đường điều hòa qua trung gian thụ cảm thể và có tính đặc hiệu cao đối với sự hấp thu LDL vừa kể trên thì các đại thực bào cũng sở hữu các mức hoạt động cao của thụ cảm thể dọn dẹp (scavenger receptor – SR). Các thụ cảm thể này, được gọi là thụ cảm thể dọn dẹp loại (class) A (SR-A), có thể liên kết với nhiều loại ligands và điều hòa sự nhập bào của LDL được chỉnh sửa về mặt hóa học mà trong đó thành phần lipid hoặc apo B đã bị oxy hóa. Không giống thụ cảm thể LDL, SR không được điều hòa giảm trong đáp ứng với mức cholesterol nội bào tăng. Cholesteryl esters tích tụ trong các đại thực bào và gây ra sự chuyển dạng của chúng thành các tế bào “bọt” (foam cells), thành phần mà tham gia vào sự hình thành của mảng xơ vữa (Hình 23). LDL-C là nguyên nhân xơ vữa động mạch chủ yếu.
E. Chuyển hóa lipoprotein mật độ cao
HDLs bao gồm một họ các lipoproteins không đồng nhất với một sự chuyển hóa phức tạp mà vẫn chưa được hiểu hoàn toàn. Các phần tử HDL được hình thành trong máu bởi sự bổ sung của lipid vào trong apo A-1, một apolipoprotein được tạo thành và bài tiết bởi gan và ruột. Apo A-1 chiếm khoảng 70% lượng apolipoproteins trong HDL. HDLs thực hiện một số chức năng quan trọng, bao gồm các chức năng sau.
1. Sự cung cấp apolipoprotein: Các phần tử HDL đóng vai trò như là một nơi tích trữ tuần hoàn của apo C-II (apolipoprotein mà được chuyển đến VLDL và chylomicrons và là một chất hoạt hóa của LPL) và apo E (apolipoprotein cần cho sự nhập bào qua trung gian thụ cảm thể của IDLs và các phần thừa chylomicron).
2. Sự hấp thu cholesterol không được ester hóa: Các HDLs mới tạo thành (nascent HDLs) là các phần tử hình đĩa chứa chủ yếu phospholipid (phần lớn là PC) và apo A, C và E. Chúng hấp thu cholesterol từ các mô không phải gan (mô ngoại vi) và đưa nó trở về gan dưới dạng cholesteryl esters (Hình 24). (Chú ý: Các phần tử HDL là các chất nhận tuyệt vời của cholesterol không được ester hóa do nồng độ cao phospholipids của chúng, là chất hòa tan quan trọng của cholesterol).
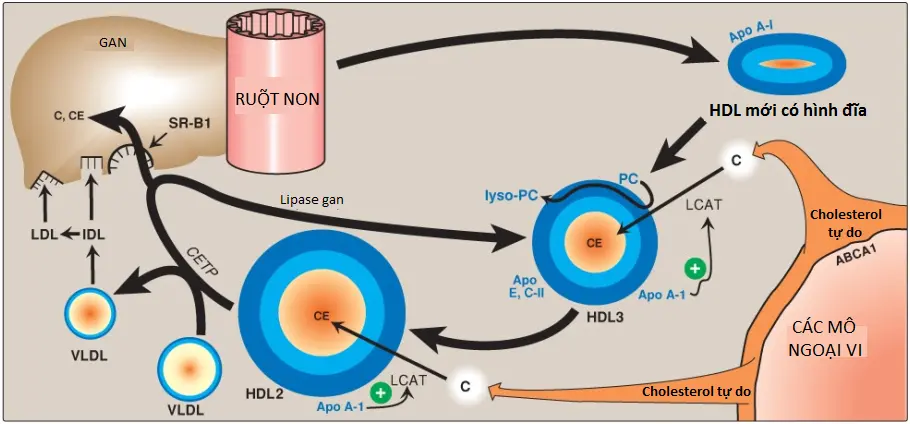
3. Sự ester hóa của cholesterol: Cholesterol thu được bởi HDL thì được ester hóa ngay lập tức bởi enzyme huyết tương là lecithin:cholesterol acyltransferase (LCAT, còn được gọi là PCAT, trong đó P là viết tắt cho PC, nguồn của acid béo). Enzyme này được tổng hợp và bài tiết bởi gan. LCAT liên kết với HDL mới tạo và được hoạt hóa bởi apo A-I. LCAT chuyển acid béo từ carbon 2 của PC đến cholesterol. Quá trình này tạo ra một cholesteryl ester kỵ nước, được cô lập trong lõi của HDL, và lysophosphatidylcholine, thành phần liên kết với albumin. (Chú ý: Sự ester hóa duy trì gradient nồng độ cholesterol, cho phép dòng cholesterol liên tục đến HDL). Khi HDL mới tạo có hình đĩa tích tụ cholesteryl esters thì đầu tiên nó trở thành một HDL3 hình cầu tương đối nghèo cholesteryl ester, và cuối cùng, trở thành một phần tử HDL2 giàu cholesteryl ester mà mang các esters này đến gan. Lipase của gan, thành phần mà thoái hóa TAG và phospholipids, tham gia vào trong sự chuyển đổi HDL2 thành HDL3 (xem Hình 24). CETP (protein vận chuyển cholesteryl ester) chuyển một ít cholesteryl esters từ HDL đến VLDL trong sự trao đổi của TAG, giải phóng sự ức chế sản phẩm (product inhibition) của LCAT. Bởi vì VLDLs được dị hóa thành LDLs nên các cholesteryl esters được chuyển bởi CETP cuối cùng được hấp thu bởi gan.
4. Sự vận chuyển cholesterol nghịch: Sự vận chuyển có chọn lọc cholesterol từ các tế bào ngoại vi đến HDL và từ HDL đến gan để tổng hợp acid mật hay loại bỏ thông qua mật là một thành phần quan trọng của cân bằng nội môi cholesterol. Quá trình vận chuyển cholesterol nghịch này (reverse cholesterol transport – RCT), một phần, là cơ sở cho mối tương quan nghịch giữa nồng độ HDL huyết tương và tình trạng xơ vữa động mạch và cho việc xác định HDL như là chất mang cholesterol “tốt”. (Chú ý: Luyện tập thể thao và estrogen làm tăng các mức HDL). RCT liên quan đến dòng ra của cholesterol từ các tế bào ngoại vi đến HDL, sự ester hóa của cholesterol bởi LCAT, sự liên kết của HDL giàu cholesteryl ester (HDL2) với gan (và có lẽ, cả các tế bào sản xuất steroid), sự chuyển có chọn lọc cholesteryl esters vào trong các tế bào này và sự giải phóng của HDL cạn kiệt lipid (HDL3). Dòng ra của cholesterol từ các tế bào ngoại vi được điều hòa chủ yếu bởi protein vận chuyển ABCA1. (Chú ý: Bệnh Tangier là một tình trạng thiếu hụt rất hiếm của ABCA1 và được đặc trưng bởi sự vắng mặt của các phần tử HDL do sự thoái hóa của apo A-1 nghèo lipid). Sự hấp thu cholesteryl ester bởi gan được điều hòa bởi thụ cảm thể bề mặt tế bào là thụ cảm thể dọn dẹp class B type 1 (SR-B1) mà liên kết HDL (xem phần VI D3 cho các thụ cảm thể SR-A). Chính phần tử HDL thì không được hấp thu. Thay vào đó, có một sự hấp thu có chọn lọc của cholesteryl ester từ phần tử HDL. (Chú ý: HDL-C thấp là một yếu tố nguy cơ đối với xơ vữa động mạch).
ABCA1 là một protein cassette liên kết ATP (ATP-binding cassette protein – ABC protein) sử dụng năng lượng từ sự thủy phân ATP để vận chuyển các chất, bao gồm lipids, vào và ra khỏi các tế bào và qua các khoang nội bào. Ngoài bệnh Tangler, các khiếm khuyết trong các ABC proteins đặc hiệu gây ra “sitosterolemia” (tình trạng tích tụ sitosterol trong cơ thể), bệnh xơ nang, loạn dưỡng chất trắng thượng thận liên kết NST-X, hội chứng suy hô hấp do sự giảm sự bài tiết surfactant và bệnh gan do giảm sự bài tiết muối mật.
F. Lipoprotein (a) và bệnh tim
Lp(a), thì gần như tương tự về mặt cấu trúc với một phần tử LDL. Đặc điểm khác biệt của nó là sự xuất hiện của thêm một phân tử apolipoprotein, là apo(a), là thành phần được liên kết cộng hóa trị ở một vị trí đơn với apo B-100. Apo(a) thì tương đồng về mặt cấu trúc với plasminogen, tiền thân của một protease máu mà mục tiêu của nó là fibrin. Fibrin là thành phần protein chính của các cục máu đông (xem các bài viết tiếp theo). Lp(a) là một yếu tố nguy cơ độc lập đối với bệnh tim mạch vành. Thành phần apo(a) của các phần tử Lp(a) được chỉ ra là làm tăng cường sự tạo mảng xơ vữa. Các mức tuần hoàn của Lp(a) được xác định chủ yếu bởi di truyền. Tuy nhiên, chế độ ăn có thể đóng một ít vai trò, như acid béo dạng trans được ghi nhận là làm tăng Lp(a). Mặt khác, niacin làm giảm Lp(a), cũng như là LDL-C và TAG, nhưng làm tăng HDL-C.
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/chuyen-hoa-cholesterol-lipoprotein-va-steroid-phan-3/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!





































