V. Các acids mật và các muối mật
Mật bao gồm một hỗn hợp dạng nước của các hợp chất hữu cơ và vô cơ. Phosphatidylcholine (PC) hay lecithin (xem các bài viết trước) và các muối mật liên hợp là các thành phần hữu cơ quan trọng nhất về mặt định lượng của mật. Mật có thể đi một cách trực tiếp từ gan, nơi mà nó được tổng hợp, vào trong tá tràng qua ống mật chủ, hoặc được tích trữ trong túi mật, khi mà nó không được cần đến ngay cho sự tiêu hóa.
A. Cấu trúc
Các acids mật chứa 24 carbons, với 2 hoặc 3 nhóm hydroxyl và một chuỗi bên mà tận cùng bằng một nhóm carboxyl (Hình 9A). Nhóm carboxyl có một pKa là khoảng 6. Trong tá tràng (pH khoảng 6), nhóm này sẽ được proton hóa ở một nửa số lượng phân tử (các acids mật) và deproton hóa phần còn lại (các muối mật). Thuật ngữ acid mật và muối mật thường được sử dụng thay thế cho nhau. Cả hai dạng đều có các nhóm hydroxyl mà có định hướng α (chúng nằm dưới mặt phẳng các vòng) và các nhóm methyl mà có định hướng β (chúng nằm phía trên mặt phẳng các vòng). Vì thế, các phân tử có cả một mặt phân cực và không phân cực và có thể đóng vai trò như là các chất nhũ hóa trong ruột, giúp xử lý chất béo trong chế độ ăn (triacylglycerol [TAG]) và các lipids phức tạp khác cho sự thoái hóa bởi các enzymes tiêu hóa của tụy (Hình 9B).

B. Sự tổng hợp
Các acids mật được tổng hợp trong gan bởi một con đường nhiều bước, đa bào quan mà trong đó các nhóm hydroxyl được chèn ở các vị trí chuyên biệt trên cấu trúc steroid; liên kết đôi của vòng cholesterol B bị khử; và chuỗi hydrocarbon được làm ngắn đi 3 carbons, tạo ra một nhóm carboxyl ở cuối chuỗi. Hợp chất tạo thành thường gặp nhất, cholic acid (một triol) và chenodeoxycholic acid (một diol), như được thể hiện trong Hình 9B, được gọi là các acids mật nguyên phát (primary bile acids). Bước giới hạn tốc độ trong sự tổng hợp acid mật là sự tạo thành của một nhóm hydroxyl ở carbon 7 của nhân steroid bởi 7-α-hydroxylase, một monooxygenase cytochrome P450 (CYP) liên kết với SER chỉ được tìm thấy trong gan. Sự biểu hiện của cholesterol 7 alpha hydroxylase được điều hòa tăng bởi cholesterol và điều hòa giảm bởi các acids mật (Hình 10). Các mức cholesterol tăng lên trong gan sẽ kích thích thụ cảm thể của nhân là thụ cảm thể X của gan (liver X receptor – LXR), điều này làm tăng sự dịch mã của cholesterol-7-alpha hydroxylase. Các mức acids mật tăng lên làm hoạt hóa một thụ cảm thể nhân khác là thụ cảm thể acid mật (bile acid receptor – BAR, còn được gọi là thụ cảm thể X farnesoid [farnesoid X receptor – FXR]) làm điều hòa giảm sự dịch mã của cholesterol 7 alpha hydroxylase.

C. Sự liên hợp
Trước khi các acids mật rời gan, chúng được liên hợp với một phân tử glycine hoặc taurine (một sản phẩm cuối cùng của chuyển hóa cysteine) bởi một liên kết giữa nhóm carboxyl của acid mật và nhóm amino của hợp chất được thêm vào. Các cấu trúc mới này bao gồm glycocholic acid và glycochenodeoxycholic acid, và taurocholic acid và taurochenodeoxycholic acid (Hình 11). Tỷ số của dạng glycine với dạng taurine trong mật là khoảng 3/1. Sự thêm vào của glycine và taurine tạo ra sự hiện diện của một nhóm carboxyl với một pKa thấp hơn (từ glycine) hoặc một nhóm sulfonate (từ taurine), cả hai đều được ion hóa hoàn toàn (tích điện âm) ở pH kiềm của mật và tá tràng. Các muối mật ion hóa liên hợp là các “chất tẩy rửa” (detergents) hiệu quả hơn so với các dạng không liên hợp bởi vì bản chất lưỡng tính của chúng được tăng cường. Vì thế, chỉ các dạng liên hợp là được tìm thấy trong mật. Những người mắc các sự thiếu hụt di truyền trong sự chuyển đổi cholesterol thành các acids mật được điều trị với chenodeoxycholic acid ngoại sinh.

Muối mật cung cấp cơ chế quan trọng duy nhất cho sự bài tiết cholesterol, cả dưới dạng một sản phẩm chuyển hóa của cholesterol và dưới dạng một chất làm tan của cholesterol trong mật.
D. Tuần hoàn ruột-gan
Các muối mật được bài tiết vào trong ruột thì được tái hấp thu một cách hiệu quả (>95%) và được tái sử dụng. Gan bài tiết một cách chủ động các muối mật thông qua bơm bài tiết muối mật. Trong ruột, chúng được tái hấp thu trong hồi tràng tận cùng thông qua bơm đồng vận chuyển muối mật-natri của màng đỉnh và trở vào trong máu thông qua một hệ thống vận chuyển riêng. (Chú ý: Litocholic acid là thành phần duy nhất được hấp thu kém). Chúng được thu nhận một cách hiệu quả từ máu bởi các tế bào gan thông qua một isoform của kênh đồng vận chuyển. (Chú ý: Albumin liên kết với các muối mật và vận chuyển chúng qua máu giống với acid béo). Chu trình liên tục của sự bài tiết muối mật vào trong mật, sự đi qua tá tràng (nơi mà một số bị tách liên hợp sau đó bị dehydroxyl hóa thành các muối mật thứ cấp [secondary bile salts]), sự hấp thu trong hồi tràng, và sự trở lại gan kế tiếp (dưới dạng một hỗn hợp của các dạng nguyên phát và thứ phát) được gọi là tuần hoàn ruột-gan (Hình 12). Khoảng 15 đến 30 grams muối mật được bài tiết từ gan vào trong tá tràng mỗi ngày, nhưng chỉ khoảng 0.5 gram (<3%) là bị mất trong phân. Gần 0.5 grams/ngày được tổng hợp từ cholesterol trong gan để thay thế lượng mất. Các chất cô lập acid mật, như cholestyramine, liên kết với các muối mật trong ruột và ngăn ngừa sự tái hấp thu của chúng, bằng cách đó tăng cường sự bài tiết của chúng. Chúng được sử dụng trong điều trị tăng cholesterol máu bởi vì sự loại bỏ của các acid mật làm giảm sự ức chế của quá trình tổng hợp acid mật trong gan, bằng cách đó, đưa nhiều cholesterol hơn vào trong con đường chuyển hóa. (Chú ý: Chất xơ trong chế độ ăn cũng liên kết với các muối mật và làm tăng sự bài tiết của chúng [xem các bài viết sau]).

E. Hoạt động của vi khuẩn trên các muối mật
Sau tuần hoàn ruột-gan, một lượng nhỏ các muối mật được bài tiết đến ruột già, nơi mà các muối mật được chỉnh sửa bởi các vi khuẩn từ hệ vi khuẩn đường ruột. Các vi khuẩn của hệ vi khuẩn ruột có thể tách liên hợp (loại bỏ glycine và taurine) các muối mật. Chúng cũng có thể dehydroxyl hóa carbon 7, tạo thành các acid mật thứ phát như deoxycholic acid từ cholic acid và lithocholic acid từ chenodeoxycholic acid. Một phần nhỏ của các acids mật thứ phát này được hấp thu bởi biểu mô ruột già và có thể được liên hợp và hydroxyl hóa bởi các enzymes gan để tạo thành các muối mật thứ phát. Phần còn lại được loại bỏ trong phân.
F. Sự thiếu hụt muối mật: sỏi mật (cholelithiasis)
Sự di chuyển của cholesterol từ gan vào trong mật phải được kèm theo bởi sự bài tiết đồng thời của phospholipid và các muối mật. Nếu như quá trình song song này bị gián đoạn và nhiều cholesterol có mặt hơn lượng mà có thể được hòa tan bởi các muối mật và PC thì cholesterol có thể tích tụ trong túi mật, dẫn đến bệnh sỏi mật (cholelithiasis) (Hình 13). Rối loạn này thường được gây ra bởi một sự giảm của các acid mật trong mật. Sỏi mật cũng có thể do tăng bài tiết cholesterol vào trong mật, như được quan sát thấy trong việc sử dụng fibrates (như gemfibrozil) để làm giảm cholesterol (và TAG) trong máu. Phẫu thuật cắt túi mật nội soi (phẫu thuật loại bỏ túi mật qua một lỗ nhỏ) là phương pháp điều trị được lựa chọn hiện này. Tuy nhiên, đối với những bệnh nhân không thể trải qua phẫu thuật, thì sử dụng chenodeoxycholic đường uống để cung cấp cho cơ thể các acids mật mà gây ra sự hòa tan dần dần (nhiều tháng đến nhiều năm) của các sỏi mật. (Chú ý: Các sỏi cholesterol chiếm hơn 85% các trường hợp sỏi mật, và các sỏi billirubin và sỏi hỗn hợp chiếm phần còn lại).

VI. Lipoproteins huyết tương
Các lipoproteins huyết tương là các phức hợp đại phân tử hình cầu của các lipids và các proteins (apolipoproteins). Các phần tử lipoprotein bao gồm các chylomicrons, các phần thừa của chylomicrons, các lipoproteins mật độ rất thấp (VLDLs), các phần thừa của VLDL, còn được gọi là các lipoproteins mật độ trung bình (IDLs), các lipoproteins mật độ thấp (LDLs), các lipoproteins mật độ cao (HDLs) và lipoprotein (a) (Lp[a]). Chúng khác nhau trong thành phần protein và lipid, kích thước, mật độ (Hình 14), và nguồn gốc. (Chú ý: Bởi vì các phần tử lipoprotein luôn luôn thay thế các lipids và apolipoproteins nên thành phần apolipoprotein và lipid thực sự của mỗi loại phần tử thì hơi thay đổi). Các lipoproteins thực hiện chức năng trong cả việc giữ các thành phần lipids được hòa tan khi vận chuyển trong huyết tương và cung cấp một cơ chế hiệu quả cho sự vận chuyển các thành phần lipids của chúng đến (hoặc từ) các mô. Ở người, có một sự tích tụ dần dần của lipid (đặc biệt là cholesterol) trong các mô.

A. Thành phần
Các lipoproteins bao gồm một lõi lipid trung tính (chứa TAG và cholesteryl esters) được bao quanh bởi một vỏ apolipoproteins, phospholipid và cholesterol không ester hóa (tự do) lưỡng tính (Hình 15). Các hợp chất lưỡng tính này được định hướng sao cho các phần phân cực được tiếp xúc trên bề mặt của lipoprotein, bằng cách đó, làm cho phần tử tan trong dung dịch nước. TAG và cholesterol được mang bởi các lipoproteins thu được từ cả chế độ ăn (nguồn ngoại sinh) hoặc từ sự tổng hợp mới (nguồn nội sinh). (Chú ý: Thành phần cholesterol [C] của các lipoproteins huyết tương bây giờ được đo thường xuyên trong máu lúc đói. Phương trình Friedewald [LDL-C = C toàn phần – HDL-C – TAG/5] được sử dụng để tính toán LDL-C một khi C toàn phần, HDL và TAG được đo trong huyết thanh. Phương trình này thừa nhận tỷ số TAG/cholesterol trong VLDL là 5:1. Giá trị mục tiêu đối với cholesterol toàn phần là <200 mg/dl).
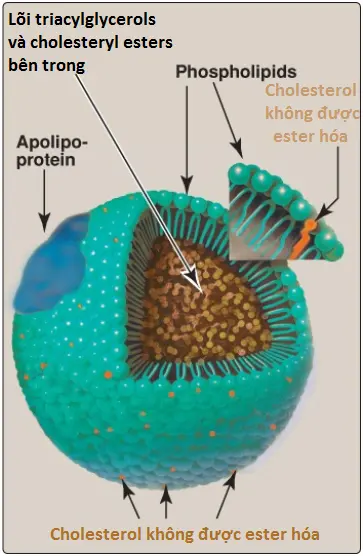
1. Kích thước và mật độ: Chylomicrons là các phần tử lipoprotein có mật độ thấp nhất và có kích thước lớn nhất mà chứa phần trăm lipid cao nhất (dưới dạng TAG) và phần trăm protein thấp nhất. VLDLs và LDLs lần lượt đặc hơn, có các tỷ số protein so với lipid cao hơn. Các phần tử HDL là nhỏ nhất và đặc nhất. Các lipoproteins huyết tương có thể được phân loại dựa trên độ di động trên điện di của chúng, như được thể hiện trong Hình 16, hoặc dựa trên cơ sở mật độ của chúng bằng siêu ly tâm.

2. Apolipoproteins: Các apolipoproteins liên kết với các phần tử lipoprotein có một số chức năng phong phú như cung cấp các vị trí nhận diện cho các thụ cảm thể bề mặt tế bào và đóng vai trò như là các chất hoạt hóa hoặc các coenzymes đối với các enzymes liên quan đến sự chuyển hóa lipoprotein. Một số apolipoproteins cần đến như là các thành phần cấu trúc thiết yếu của các phần tử và không thể được loại bỏ (trong thực tế, các phần tử không thể được sản xuất ra mà không có nó), ngược lại, các apolipoproteins khác được vận chuyển một cách tự do giữa các lipoproteins. Các apolipoproteins được phân loại bởi cấu trúc và chức năng thành một số loại chính, ký hiệu bởi các chữ cái, mỗi loại lại có các loại nhỏ (như apolipoprotein [apo] C-I, apo C-II và apo C-III). (Chú ý: Các chức năng của tất cả các apolipoproteins thì vẫn chưa được hiểu rõ).
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/chuyen-hoa-cholesterol-lipoprotein-va-steroid-phan-1/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!





































