Cầm máu, các rối loạn chảy máu và huyết khối
Huyết khối (thrombosis)
Tăng đông máu
Tăng đông máu là tình trạng máu có xu hướng đông cao bất thường và thường do những thay đổi trong các yếu tố đông máu gây ra. Tăng đông máu có vai trò đặc biệt quan trọng trong huyết khối tĩnh mạch và có thể được chia thành các rối loạn nguyên phát (di truyền) và thứ phát (mắc phải) (Bảng 4.2). Trong số các nguyên nhân di truyền của tình trạng tăng đông máu, đột biến điểm ở gene yếu tố V và gene prothrombin là phổ biến nhất. Chúng được liệt kê dưới đây:

- Yếu tố V Leiden. Khoảng 2% đến 15% người da trắng mang đột biến một nucleotide trong yếu tố V được gọi là yếu tố V Leiden, theo tên thành phố ở Hà Lan nơi phát hiện ra yếu tố này. Trong số những người bị DVT tái phát, tần suất đột biến này cao hơn đáng kể, lên tới 60%. Đột biến này khiến yếu tố V kháng lại sự phân cắt và bất hoạt của protein C. Kết quả là, một con đường điều hòa chống huyết khối quan trọng bị mất (xem Hình 4.10). Kiểu di truyền của yếu tố V Leiden là trội trên nhiễm sắc thể thường. Những người dị hợp tử có nguy cơ huyết khối tĩnh mạch tăng gấp năm lần, và những người đồng hợp tử có nguy cơ tăng gấp 50 lần.

- Đột biến gen prothrombin. Một đột biến phổ biến khác (1% đến 2% dân số) liên quan đến tình trạng tăng đông là một thay đổi nucleotide đơn (G20210A) ở vùng không dịch mã 3′ của gene prothrombin. Đột biến này dẫn đến nồng độ prothrombin tăng cao và nguy cơ huyết khối tĩnh mạch tăng gần gấp ba lần.
- Các nguyên nhân di truyền khác. Các nguyên nhân di truyền hiếm gặp của tình trạng tăng đông nguyên phát bao gồm tình trạng thiếu hụt chất chống đông như antithrombin III, protein C hoặc protein S; những người bị ảnh hưởng thường có biểu hiện huyết khối tĩnh mạch và tắc mạch huyết khối tái phát bắt đầu từ tuổi vị thành niên hoặc đầu tuổi trưởng thành.
- Tăng homocysteine máu. Nồng độ homocysteine tăng cao có thể do di truyền hoặc mắc phải. Nồng độ homocysteine tăng cao rõ rệt có thể do thiếu hụt cystathione β-synthetase di truyền. Nguyên nhân mắc phải bao gồm thiếu hụt vitamin B6, B12 và folic acid. Tác dụng gây huyết khối của homocysteine có thể là do các liên kết thioester hình thành giữa các chất chuyển hóa homocysteine và nhiều loại protein, bao gồm fibrinogen.
Các kiểu genes ưa huyết khối phổ biến nhất được tìm thấy trong nhiều dân số khác nhau (dị hợp tử đối với yếu tố V Leiden và dị hợp tử đối với biến thể prothrombin G20210A) chỉ gây ra nguy cơ huyết khối tăng vừa phải; hầu hết những người có các kiểu genes này, khi khỏe mạnh, đều không bị biến chứng huyết khối. Tuy nhiên, đột biến yếu tố V và prothrombin đủ thường xuyên để thể đồng hợp tử và dị hợp tử kép không còn hiếm, và những kiểu gene như vậy có liên quan đến nguy cơ cao hơn. Hơn nữa, những người có các đột biến như vậy có tần suất huyết khối tĩnh mạch tăng đáng kể trong bối cảnh của các yếu tố nguy cơ mắc phải khác (ví dụ: mang thai hoặc nằm liệt giường kéo dài). Do đó, dị hợp tử yếu tố V Leiden có thể gây ra huyết khối tĩnh mạch sâu (DVT) khi kết hợp với tình trạng không hoạt động bắt buộc, chẳng hạn như trong chuyến bay kéo dài. Do đó, nguyên nhân di truyền gây tăng đông máu phải được xem xét ở những bệnh nhân dưới 50 tuổi bị huyết khối – ngay cả khi có các yếu tố nguy cơ mắc phải.
Không giống như các rối loạn di truyền, cơ chế bệnh sinh của bệnh ưa huyết khối mắc phải thường là đa yếu tố (xem Bảng 4.2). Trong một số trường hợp (ví dụ, suy tim hoặc chấn thương), tình trạng ứ trệ hoặc tổn thương mạch máu có thể là quan trọng nhất. Tăng đông do sử dụng thuốc tránh thai đường uống hoặc tình trạng tăng estrogen khi mang thai có thể là do tăng tổng hợp các yếu tố đông máu ở gan và giảm tổng hợp chất chống đông. Trong các bệnh ung thư lan tỏa, việc giải phóng nhiều chất gây đông máu từ khối u làm tăng nguy cơ huyết khối. Tăng đông thấy ở người cao tuổi có thể là do giảm sản xuất PGI2 nội mạc. Hút thuốc lá và béo phì thúc đẩy tăng đông bằng các cơ chế chưa rõ.
Trong số các tình trạng ưa huyết khối mắc phải, giảm tiểu cầu do heparin và hội chứng kháng thể kháng phospholipid là những vấn đề lâm sàng đặc biệt quan trọng cần được đề cập cụ thể.
Hội chứng giảm tiểu cầu do heparin (HIT)
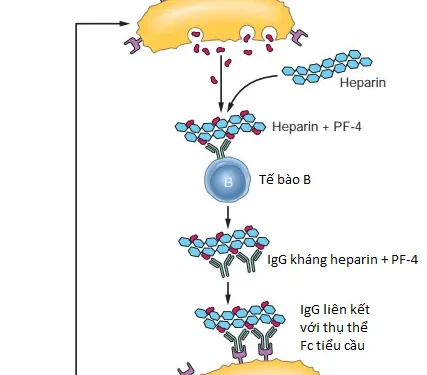
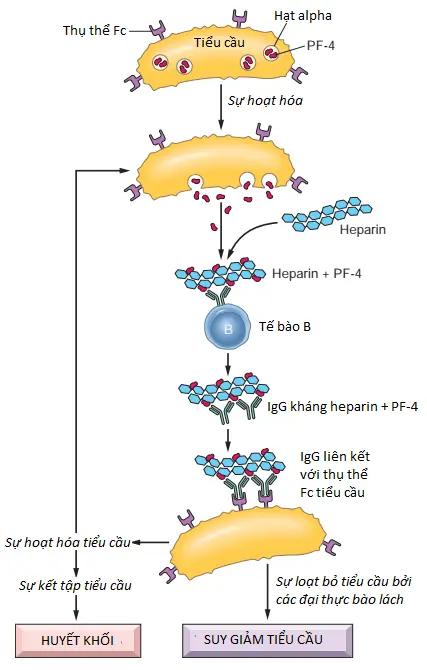
Hội chứng HIT là một rối loạn nghiêm trọng, có khả năng đe dọa tính mạng xảy ra sau khi dùng heparin không phân đoạn. Nó là kết quả của sự hình thành các kháng thể nhận diện phức hợp heparin và PF4 trên bề mặt tiểu cầu (Chương 14), cũng như các phức hợp của các phân tử giống heparin và các protein giống PF4 trên các tế bào nội mô. Protein PF4 thường có trong các hạt alpha của tiểu cầu và được giải phóng khi tiểu cầu được hoạt hóa. PF4 được giải phóng sẽ liên kết với heparin và trải qua một sự thay đổi về cấu hình dẫn đến sự hình thành một tân kháng nguyên mà các kháng thể IgG được hình thành để chống lại nó. Phức hợp miễn dịch PF4-IgG (Hình 4.13) gắn vào và liên kết chéo các thụ thể Fc trên bề mặt tiểu cầu, dẫn đến hoạt hóa và kết tập tiểu cầu. Hoạt hóa tiểu cầu dẫn đến giải phóng nhiều PF4 hơn, tạo ra nhiều kháng nguyên đích hơn cho các kháng thể HIT. Trạng thái gây huyết khối cũng có thể được tăng cường bởi sự hoạt hóa của nội mô bằng sự liên kết của các kháng thể HIT với các protein giống PF4 trên bề mặt của chúng. Sự liên kết của kháng thể HIT với tiểu cầu dẫn đến việc chúng bị đại thực bào loại bỏ (do đó có tên hội chứng là giảm tiểu cầu). Mặc dù giảm tiểu cầu là biểu hiện phổ biến nhất nhưng huyết khối là biến chứng nghiêm trọng nhất. Nó xảy ra ở khoảng 50% các trường hợp và ảnh hưởng đến cả tĩnh mạch và động mạch. Hoại tử da, hoại thư các chi, đột quỵ và nhồi máu cơ tim là một số di chứng. Chẩn đoán đòi hỏi phải chứng minh được sự có mặt của kháng thể kháng PF4-heparin. Các chế phẩm heparin trọng lượng phân tử thấp ít gây ra HIT hơn và các nhóm thuốc chống đông khác như chất ức chế trực tiếp yếu tố X và thrombin cũng có thể loại trừ nguy cơ này.
Hội chứng kháng thể kháng phospholipid
APS là một rối loạn tự miễn đặc trưng bởi:
- Có một hoặc nhiều tự kháng thể kháng phospholipid (aPL)
- Huyết khối tĩnh mạch hoặc động mạch, hoặc các biến chứng khi mang thai như sảy thai tái lại, thai chết lưu không rõ nguyên nhân và sinh non.
APS có thể là nguyên phát hoặc thứ phát. Những người mắc bệnh tự miễn được xác định rõ, chẳng hạn như lupus ban đỏ hệ thống (Chương 6), được xác định là mắc hội chứng kháng phospholipid thứ phát (do đó có thuật ngữ trước đây là hội chứng kháng đông lupus). Trong hội chứng kháng phospholipid nguyên phát, bệnh nhân chỉ biểu hiện các biểu hiện của tình trạng tăng đông và không có bằng chứng về các rối loạn tự miễn được xác định rõ khác. Khoảng 50% bệnh nhân mắc APS có dạng nguyên phát, phần còn lại xảy ra liên quan đến bệnh tự miễn được xác định rõ, phổ biến nhất là SLE. Trọng tâm của chúng ta ở đây là dạng nguyên phát.
Các biểu hiện lâm sàng của APS rất đa dạng; chúng bao gồm huyết khối tái phát, sảy thai nhiều lần, sùi van tim và giảm tiểu cầu. Tùy thuộc vào mạng mạch máu liên quan, các biểu hiện lâm sàng có thể bao gồm thuyên tắc phổi (sau huyết khối tĩnh mạch chi dưới), tăng áp phổi (do thuyên tắc phổi dưới lâm sàng tái phát), bệnh van tim, đột quỵ, nhồi máu ruột hoặc tăng huyết áp mạch máu thận.
Cơ chế bệnh sinh của hội chứng kháng phospholipid thì phức tạp và chưa được hiểu đầy đủ. Các kháng thể aPL hướng đến các phospholipid màng tích điện âm hoặc các proteins liên kết với phospholipid. Các phospholipids và proteins được các kháng thể này nhận diện bao gồm cardiolipin và β2-glycoprotein I. Glycoprotein này được tìm thấy trong huyết tương, nhưng nó có ái lực mạnh đối với phospholipids mà được biểu hiện trên bề mặt của các tế bào nội mô, bạch cầu đơn nhân, tiểu cầu, nguyên bào nuôi và thrombin. Các kháng thể kháng β2-glycoprotein được cho là có vai trò chính trong APS bằng cách kích hoạt các tế bào nội mô, bạch cầu đơn nhân và tiểu cầu. Khả năng gây bệnh của chúng được củng cố bởi quan sát rằng việc truyền các kháng thể này vào loài gặm nhấm có thể gây ra huyết khối. Bệnh nhân mắc APS cũng cho thấy bằng chứng về hoạt hóa bổ thể và ức chế các quá trình tiêu sợi huyết, cả hai đều có lợi cho trạng thái gây huyết khối. Như đã đề cập trước đó, tình trạng bệnh tật khi mang thai là biểu hiện xác định của APS. Tuy nhiên, không giống như hầu hết các đặc điểm lâm sàng khác, tình trạng mất thai dường như không phải do huyết khối gây ra, mà dường như bắt nguồn từ sự can thiệp của kháng thể vào sự phát triển và biệt hóa của nguyên bào nuôi, dẫn đến tình trạng suy yếu hình thành nhau thai.
Mặc dù kháng thể kháng phospholipid rõ ràng có liên quan đến bệnh lý huyết khối, nhưng chúng cũng được phát hiện ở 5% đến 15% những cá nhân có vẻ bình thường, ngụ ý rằng chúng không đủ để gây ra hội chứng toàn phát. Người ta cho rằng cần phải có “đòn tấn công thứ hai” có thể do nhiễm trùng, hút thuốc lá hoặc mang thai, trong số nhiều nguyên nhân khác. Mặc dù các kháng thể này gây ra trạng thái tăng đông trong cơ thể sống, nhưng chúng gây trở ngại cho phospholipids và do đó ức chế quá trình đông máu trong ống nghiệm, bằng cách này kéo dài PTT. Các kháng thể cũng thường dẫn đến xét nghiệm huyết thanh dương tính giả đối với bệnh giang mai vì kháng nguyên trong mẫu xét nghiệm chuẩn được cố định trên cardiolipin, điều mà gây ra phản ứng chéo với phospholipid của Treponema pallidum. Chẩn đoán APS dựa trên các đặc điểm lâm sàng và biểu hiện của các kháng thể aPL trong huyết thanh. Liệu pháp điều trị APS bao gồm nhiều dạng thuốc chống đông khác nhau.
Các bạn xem bài viết mới trên Facebook tại đây: https://www.facebook.com/61550892771585/
Các bạn xem bài viết trước tại đây: https://docsachxyz.com/cac-roi-loan-huyet-dong-benh-huyet-khoi-va-shock-phan-4/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!