I. Tổng quan
Ở bài viết trước thì mình đã mô tả các loại cấu trúc bậc hai và bậc ba mà giúp hình thành nên “kiến trúc” của protein. Bằng cách sắp xếp những thành phần cấu trúc cơ bản này theo các sự kết hợp khác nhau, các proteins rất phong phú có các chức năng đặc hiệu khác nhau có thể được tạo nên. Hai cấu trúc protein quan trọng là các protein hình cầu và các proteins dạng sợi (hay scleroprotein). Giống như tên của nó, các proteins hình cầu thì nhìn chung có dạng hình cầu (hoặc giống hình cầu). Chúng thường hơi tan trong nước, sở hữu nhiều các amino acids ưa nước ở trên mặt ngoài, tương tác với môi trường nước. Nhiều amino acids không phân cực khác nằm ở bên trong của protein, cung cấp các tương tác kỵ nước để có thể giúp ổn định hơn nữa cấu trúc hình cầu. Điều này thì ngược lại với các proteins hình sợi, là thành phần giúp hình thành nên các sợi dạng que, tương đối trơ hay không tan trong nước và cung cấp sự hỗ trợ về mặt cấu trúc trong môi trường ngoại bào. Bài viết này thì chúng ta sẽ khám phá mối liên hệ giữa cấu trúc và chức năng đối với các hemeprotein hình cầu quan trọng về mặt lâm sàng như hemoglobin và myoglobin. Các proteins cấu trúc dạng sợi như collagen và elastin sẽ được nói đến sau.
II. Các hemeprotein hình cầu
Các hemeproteins là một nhóm các protein hình cầu đặc hiệu chứa heme dưới dạng là một nhóm ngoại được liên kết chặt chẽ. Chức năng của nhóm heme được quy định bởi cấu trúc ba chiều của protein. Trong chuỗi truyền electron của ty thể, cấu trúc protein cytochrome cho phép sự vận chuyển nhanh chóng và thuận nghịch electron oxy hóa-khử của sắt liên kết với heme, làm cho sắt chuyển dạng thuận nghịch giữa sắt II (Fe2+) và sắt III (Fe3+). Trong enzyme catalase, nhóm heme về mặt cấu trúc là một phần của vị trí hoạt động của enzyme, làm xúc tác cho sự thoái hóa của hydrogen peroxide. Cấu trúc protein của hemoglobin có thể ảnh hưởng đến sự căn chỉnh của Fe2+ so với mặt phẳng của nhóm ngoại heme. Các sự thay đổi trong sự căn chỉnh này có thể ảnh hưởng đến ái tính liên kết và sự vận chuyển oxygen bởi hemoglobin giữa các phổi và các mô.
A. Cấu trúc heme
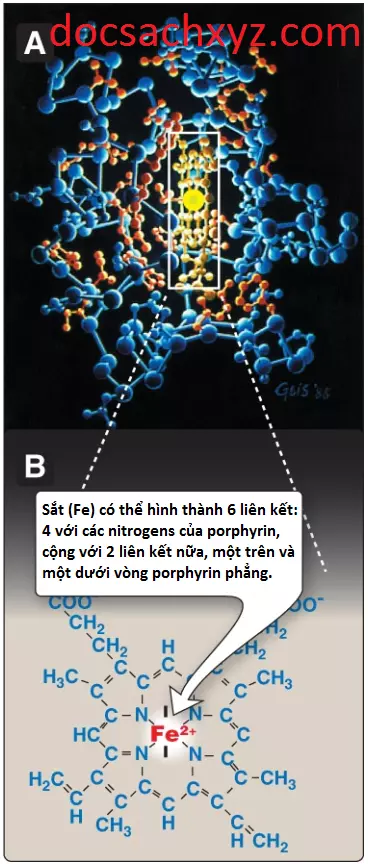
Heme là một cấu trúc dạng phẳng, bao gồm một vòng porphyrin với sắt II (Fe2+) tích hợp trong trung tâm vòng porphyrin, như trong Hình 1. Sắt được giữ ở trung tâm của phân tử heme bởi các liên kết đến 4 nitrogen của vòng porphyrin. Fe2+ của heme có thể hình thành thêm 2 liên kết nữa, mỗi liên kết ở mỗi phía của vòng porphyrin phẳng. Trong hemoglobin, một trong những vị trí này thì được thì được tích hợp vào chuỗi bên của một gốc histidine của phân tử globin, ngược lại, các vị trí khác sẽ sẵn có để liên kết với oxygen (Hình 2).
B. Cấu trúc và chức năng của myoglobin
Myoglobin, một hemeprotein xuất hiện trong cơ tim và cơ xương, vừa thực hiện chức năng như là một nơi chứa oxygen và vừa thực hiện chức năng như là một chất mang oxygen giúp làm tăng tốc độ vận chuyển oxygen bên trong tế bào cơ. Myoglobin chứa một chuỗi polypeptide đơn mà về mặt cấu trúc thì tương tự với các chuỗi polypeptide đơn của phân tử tetramer (4 phần) hemoglobin. Sự tương đồng này làm cho myoglobin trở thành một mô hình hữu ích giúp giải thích một số thuộc tính phức tạp hơn của hemoglobin.
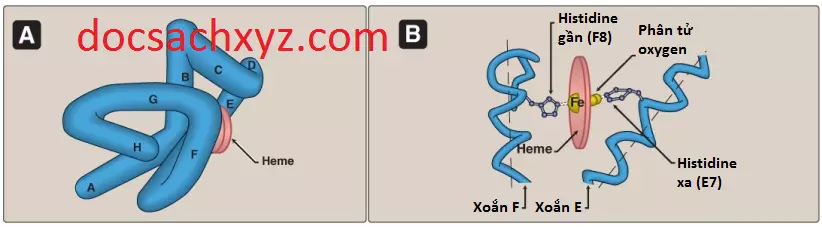
1. Thành phần xoắn alpha: Myoglobin là một phân tử đặc, với khoảng 80% chuỗi polypeptide của nó được gập thành 8 đoạn xoắn alpha. Những vùng của xoắn alpha này, được đánh dấu từ A đến H trong Hình 2A, được kết thúc bởi sự xuất hiện của proline (vòng 5 nguyên tử của nó không thể được chứa trong một xoắn alpha) hoặc bởi các gập beta và các quai được ổn định bởi các liên kết hydrogen và các liên kết ion. (Chú ý: Các liên kết ion thì cũng được gọi là các tương tác tĩnh điện hay các cầu muối).
2. Vị trí của các gốc amino acids phân cực và không phân cực: Phía bên trong của phân tử myoglobin hình cầu thì được tạo thành gần như toàn bộ là bởi các phân tử amino acids không phân cực. Các amino acids không phân cực được nén chặt với nhau, hình thành nên một cấu trúc được ổn định bởi các tương tác kỵ nước giữa những gốc kết tụ này. Ngược lại, các amino acids phân cực thì nằm gần như hoàn toàn trên bề mặt, nơi mà chúng có thể hình thành nên các liên kết hydrogen, cả với nhau và với nước.
3. Sự liên kết của nhóm heme: Nhóm ngoại heme của phân tử myoglobin sẽ nằm trong một khoảng hở được lót bởi các amino acids không phân cực. Các ngoại lệ đáng chú ý là 2 gốc histidine, là các amino acids có tính base (Hình 2B). Một trong 2 gốc histidine, histidine gần (F8), liên kết trực tiếp với Fe2+ của heme. Nhóm thứ hai, hay nhóm histidine xa (E7) thì không tương tác trực tiếp với nhóm heme nhưng nó giúp ổn định sự liên kết của oxygen với Fe2+. Vì thế, phần protein, hay globin, chính là phần myoglobin mà tạo ra một vi môi trường chuyên biệt cho heme cho phép sự oxygen hóa, là sự liên kết thuận nghịch của một phân tử oxygen. Sự mất cùng một lúc các electrons từ Fe2+ (sự oxy hóa thành dạng Fe3+) chỉ hiếm khi xảy ra.
C. Cấu trúc và chức năng của hemoglobin
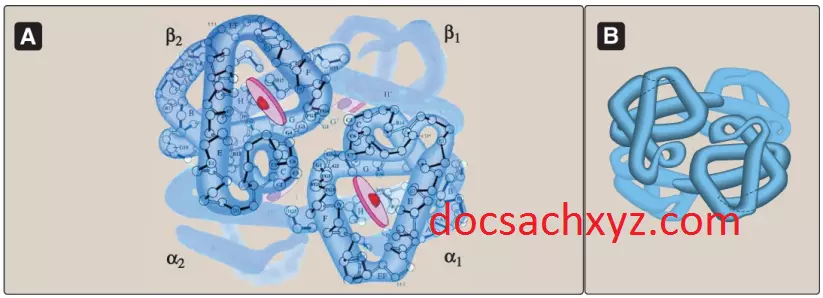
Hemoglobin được tìm thấy hoàn toàn bên trong các tế bào hồng cầu (RBCs), nơi mà chức năng chính của nó là vận chuyển oxygen từ các phổi đến các mao mạch của các mô. Hemoglobin A (HbA), hemoglobin chính ở người trưởng thành, thì được cấu tạo từ 4 chuỗi polypeptide (2 chuỗi α và 2 chuỗi β) kết hợp với nhau bởi các tương tác không phải là cộng hóa trị (Hình 3). Mỗi chuỗi (tiểu đơn vị) có các đoạn cấu trúc xoắn alpha và một khe liên kết heme kỵ nước tương tự với những gì được mô tả đối với myoglobin. Tuy nhiên, phân tử tetramer hemoglobin thì phức tạp hơn về mặt cấu trúc và chức năng so với myoglobin. Ví dụ, hemoglobin có thể vận chuyển các proton (H+) và carbon dioxide (CO2) từ các mô đến các phổi và có thể mang 4 phân tử oxygen từ các phổi đến các tế bào của cơ thể. Hơn thế nữa, các thuộc tính liên kết với oxygen của hemoglobin thì được điều hòa bởi sự tương tác với các yếu tố tác động biến cấu.
Việc thu oxygen từ khí quyển chỉ bằng khuếch tán làm hạn chế đáng kể kích thước của các sinh vật. Các hệ thống tuần hoàn khắc phục được vấn đề này, nhưng các phân tử vận chuyển như hemoglobin thì cũng cần thiết bởi vì oxygen chỉ hơi tan trong các dung dịch nước như máu.
1. Cấu trúc bậc 4: Tetramer hemoglobin có thể được hình dung là gồm 2 dimers tương tự nhau, αβ1 và αβ2. Hai chuỗi polypeptide bên trong mỗi dimer được liên kết chặt chẽ với nhau chủ yếu bởi các tương tác kỵ nước (Hình 4). (Chú ý: Trong trường hợp này, các gốc amino acid kỵ nước thì không chỉ nằm ở bên trong của phân tử mà còn nằm ở trong một vùng trên bề mặt của mỗi tiểu đơn vị. Các tương tác kỵ nước gian chuỗi giúp hình thành nên các sự liên hệ mạnh mẽ giữa tiểu đơn vị α và tiểu đơn vị β trong mỗi dimers). Ngược lại, 2 dimers được liên kết với nhau chủ yếu bởi các liên kết phân cực. Các tương tác yếu hơn giữa các dimers cho phép chúng di chuyển so với nhau. Sự chuyển động này làm cho 2 dimers chiếm lấy các vị trí tương đối khác nhau trong deoxyhemoglobin khi so sánh với oxyhemoglobin (xem Hình 4).
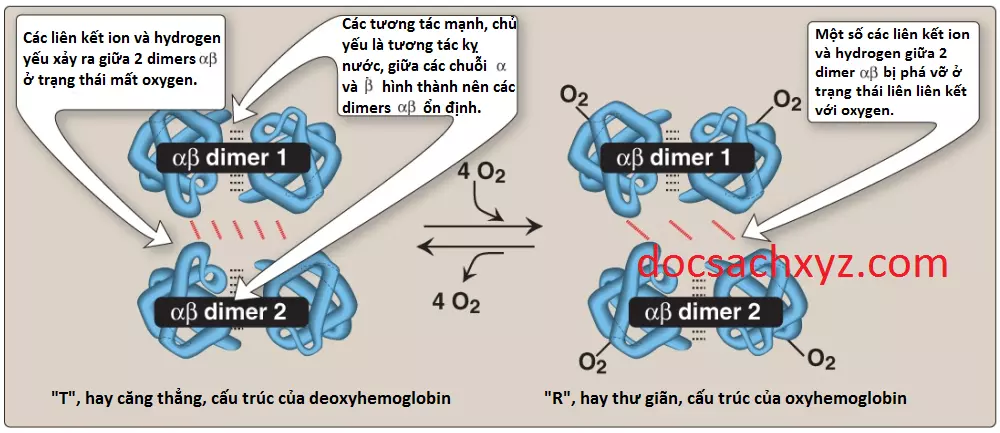
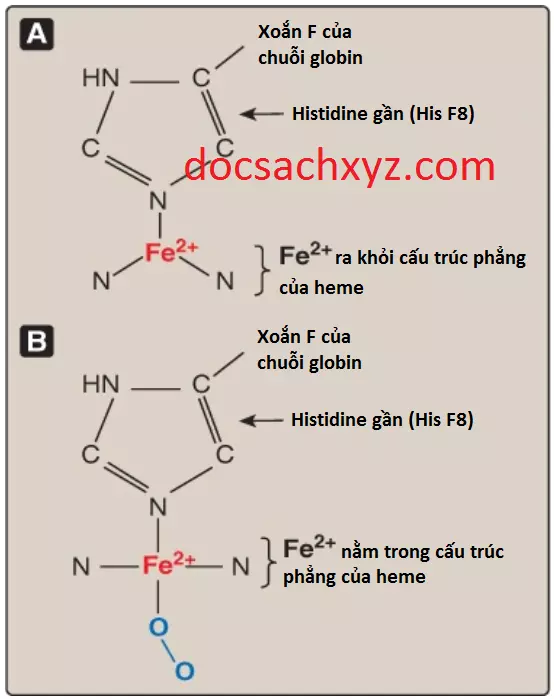
a. Dạng T: Dạng deoxy của hemoglobin được gọi là dạng “T” hay dạng taut (dạng căng thẳng). Ở dạng T, 2 dimer αβ tương tác thông qua một mạng lưới các liên kết ion và các liên kết hydrogen mà giúp hạn chế sự vận động của các chuỗi polypeptide. Sắt (Fe2+) được kéo ra khỏi mặt phẳng heme. Cấu hình T là dạng có ái tính với oxygen thấp của hemoglobin.
b. Dạng R: Sự liên kết của oxygen với hemoglobin gây ra sự đứt gãy của các liên kết phân cực giữa 2 dimer αβ, cho phép sự vận động của Fe2+ so với cấu trúc heme phẳng. Cụ thể, sự liên kết của oxygen với Fe2+ của heme sẽ kéo sắt một cách trực tiếp hơn vào trong mặt phẳng của cấu trúc vòng heme (Hình 5B). Bởi vì sắt thì cũng được liên kết với histidine gần (F8) nên sự vận động hệ quả của các chuỗi globins sẽ làm thay đổi giao diện giữa các dimer αβ, dẫn đến hình thành một cấu trúc gọi là “R” hay dạng thư giãn (xem Hình 4). Cấu hình R là dạng có ái tính cao với oxygen của hemeglobin.
D. Oxygen liên kết với myoglobin và hemoglobin
Myoglobin chỉ có thể liên kết với một phân tử oxygen bởi vì nó chỉ chứa một nhóm heme. Ngược lại, hemoglobin có thể liên kết với 4 phân tử oxygen, mỗi phân tử oxygen nằm ở một trong số 4 nhóm heme của hemoglobin. Độ bão hòa (Y) của những vị trí liên kết với oxygen này trên tất cả các phân tử myoglobin hay hemoglobin có thể thay đổi giữa 0 (tất cả các vị trí đều trống) và 100% (tất cả các vị trí đều có liên kết) như trong Hình 6. (Chú ý: Đo oxy theo nhịp mạch (pulse oximetry) là một phương pháp đo độ bão hòa oxy của máu động mạch không xâm lấn và gián tiếp dựa trên sự khác nhau trong việc hấp thụ ánh sáng của oxyhemoglobin và deoxyhemoglobin).
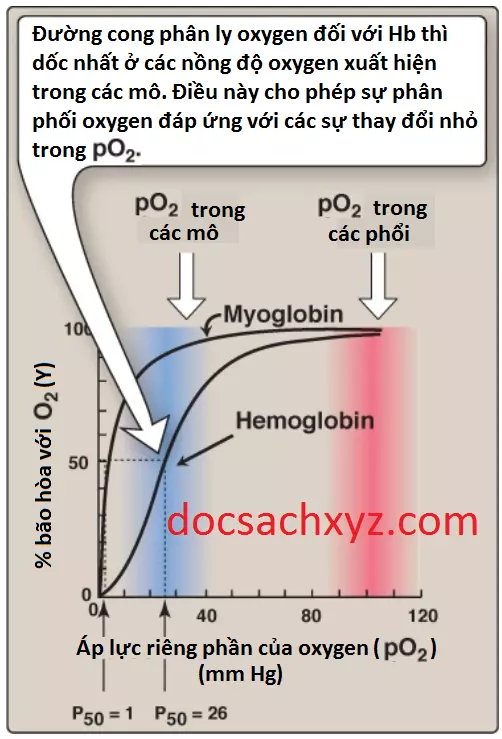
1. Đường cong phân ly oxygen: Một biểu đồ về độ bão hòa (Y) đo ở các áp lực riêng phần oxygen khác nhau (pO2) được gọi là đường cong phân ly oxygen. (Chú ý: pO2 cũng có thể được ký hiệu là PO2). Các đường cong đối với myoglobin và hemoglobin cho thấy các sự khác biệt quan trọng (xem Hình 6). Đồ thị này giúp chúng ta thấy việc myoglobin có một ái lực với oxygen cao hơn với tất cả các giá trị pO2 so với hemoglobin. Áp lực riêng phần của oxygen cần để đạt được sự bán bão hòa của các vị trí liên kết (P50) là khoảng 1 mm Hg đối với myoglobin và 26 mm Hg đối với hemoglobin. Ái tính với oxygen càng cao (nghĩa là liên kết với O2 càng chặt) thì giá trị P50 càng thấp.
a. Myoglobin: Đường cong phân ly oxygen đối với myoglobin có một hình hyperbol (xem Hình 6). Đường cong này phản ánh một điều là myoglobin liên kết một cách thuận nghịch với một phân tử O2. Vì thế, myoglobin được oxygen hóa (MbO2) và myoglobin được deoxygen hóa (Mb) sẽ tồn tại trong một cân bằng đơn giản như sau:
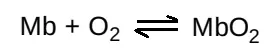
Cân bằng được dịch chuyển sang bên phải hoặc sang bên trái khi O2 được thêm vào hoặc bị loại bỏ khỏi hệ thống (Chú ý: Myoglobin có cấu hình liên kết với O2 được giải phóng bởi hemoglobin ở giá trị pO2 thấp bên trong cơ. Myoglobin cuối cùng sẽ giải phóng O2 bên trong tế bào cơ để đáp ứng với nhu cầu oxygen).
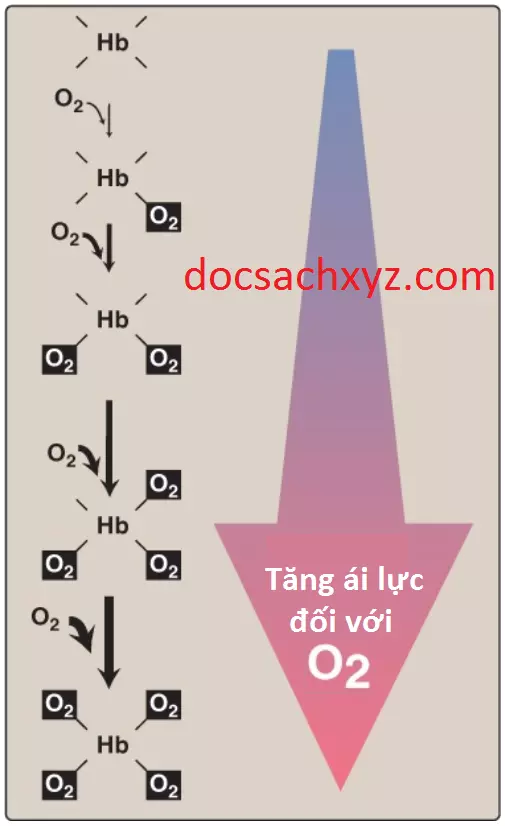
b. Hemoglobin: Đường cong phân ly oxygen đối với hemoglobin có hình dạng sigmoid (dạng đường cong hình chữ “S”) (xem Hình 6), cho thấy rằng các tiểu đơn vị có sự phối hợp trong việc liên kết với oxygen. Sự liên kết phối hợp với oxygen bởi 4 tiểu đơn vị của hemoglobin có nghĩa rằng là sự liên kết của một phân tử oxygen ở một tiểu phân sẽ làm tăng ái tính đối với oxygen của các tiểu đơn vị còn lại trong cùng một tetramer hemoglobin (Hình 7). Mặc dù sẽ khó hơn cho phân tử oxygen đầu tiên liên kết với hemoglobin nhưng các sự liên kết tiếp theo với các phân tử sẽ xảy ra với ái tính cao hơn, như được thể hiện bởi đường cong dốc hướng lên ở vùng gần 20 đến 30 mm Hg (xem Hình 6).
E. Các yếu tố tác động biến cấu
Khả năng của hemoglobin trong việc liên kết thuận nghịch với oxygen thì bị ảnh hưởng bởi pO2, pH của môi trường, áp lực riêng phần carbon dioxide (pCO2) và nồng độ của 2,3-bisphosphoglycerate (2,3-BPG). Những yếu tố này thì được gọi là các yếu tố tác động biến cấu bởi vị sự tương tác của chúng ở một vị trí trên phân tử tetramer hemoglobin gây ra các sự thay đổi về mặt cấu trúc làm ảnh hưởng đến sự liên kết của O2 với sắt của heme ở các vị trí khác trên phân tử. (Chú ý: Sự liên kết của O2 với đơn phân myoglobin thì không bị ảnh hưởng bởi các yếu tố tác động biến cấu).
1. Oxygen: Đường cong phân ly oxygen có dạng sigmoid phản ánh các sự thay đổi về mặt cấu trúc được khởi động ở một tiểu đơn vị và truyền đến các tiểu đơn vị khác trong tetramer hemoglobin. Tác động tổng thể của sự phối hợp này là ái tính của hemoglobin đối với sự liên kết với phân tử oxygen cuối cùng sẽ lớn hơn khoảng 300 lần so với ái tính của hemoglobin đối với phân tử oxygen đầu tiên. Do đó, oxygen là một yếu tố tác động biến cấu của hemoglobin. Nó giúp ổn định dạng R của hemoglobin.
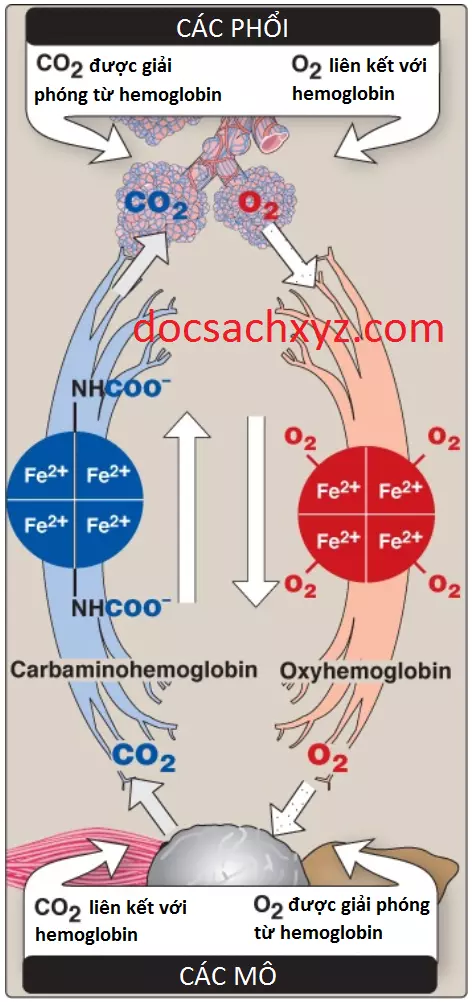
a. “Chất đầy” oxygen và “dỡ” oxygen: Sự liên kết phối hợp với oxygen cho phép hemoglobin vận chuyển nhiều O2 hơn đến các mô trong sự đáp ứng với các thay đổi tương đối nhỏ trong pO2. Điều này có thể thấy được trong Hình 6, cho thấy pO2 trong các phế nang của phổi và các mao mạch của các mô. Ví dụ, trong phổi, nồng độ oxygen thì sẽ cao và hemoglobin trở nên bão hòa (hay “chất đầy”) với oxygen. Ngược lại, trong các mô ngoại vi nơi mà pO2 thì thấp hơn nhiều so với trong phổi, oxyhemoglobin giải phóng (hay “dỡ”) nhiều oxygen để sử dụng trong sự chuyển hóa oxy hóa của các mô (Hình 8).
b. Sự quan trọng của đường cong phân ly oxygen dạng sigmoid: Dốc của đường cong phân ly oxygen trên một khoảng các nồng độ oxygen xuất hiện giữa các phổi và các mô cho phép hemoglobin mang và phân phối O2 một cách hiệu quả từ các vùng có giá trị pO2 cao đến các vùng có giá trị pO2 thấp. Một phân tử có đường cong phân ly oxygen dạng hyperbol như myoglobin thì không thể đạt được cùng mức độ giải phóng oxygen trong khoảng giá trị này của pO2. Thay vào đó, nó sẽ có ái tính tối đa đối với O2 trong suốt khoảng áp lực oxygen này và, vì thế, sẽ không phân phối O2 đến các mô.
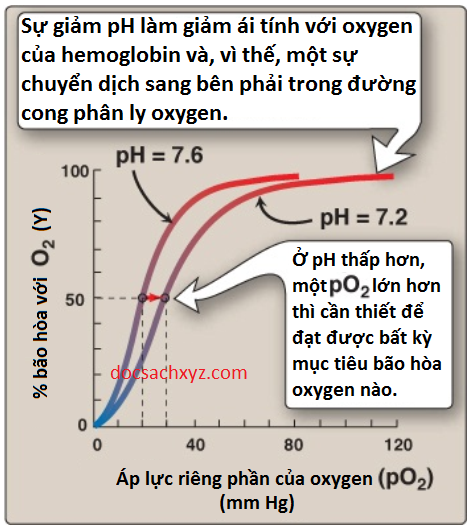
2. Hiệu ứng Bohr: Sự giải phóng của O2 từ hemoglobin thì được tăng cường khi pH hạ thấp (nồng độ proton [H+] tăng) hoặc khi hemoglobin ở nơi có sự tăng lên của pCO2. Cả hai điều này thì đều sẽ cho kết quả là giảm ái tính đối với oxygen của hemoglobin và vì thế, một sự dịch chuyển sang bên phải trong đường cong phân ly oxygen (Hình 9). Do đó, cả hai sẽ giúp ổn định dạng T (dạng deoxy) của hemoglobin. Sự thay đổi này trong liên kết với oxygen được gọi là hiệu ứng Bohr. Ngược lại, sự tăng lên của pH hay sự thấp đi của nồng độ CO2 sẽ tạo ra một ái tính với oxygen lớn hơn, một sự dịch chuyển sang bên trái trong đường cong phân ly oxygen và giúp ổn định dạng R (dạng oxy) của hemoglobin.
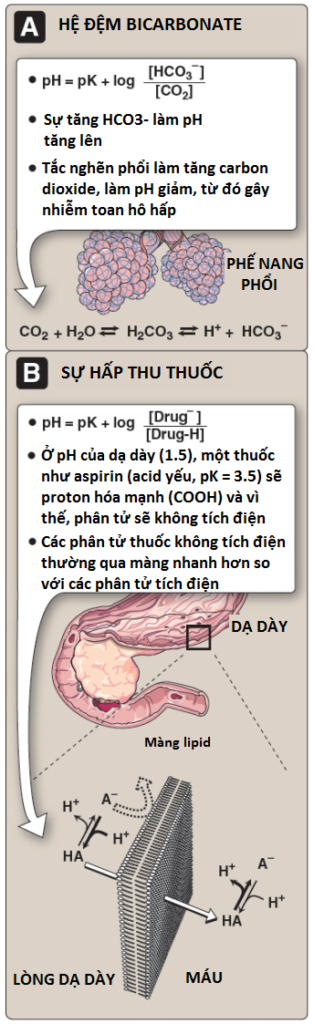
a. Nguồn proton làm thấp pH: Nồng độ của cả H+ và CO2 trong các mao mạch của các mô hoạt động về mặt chuyển hóa thì cao hơn so với các mao mạch phế nang của phổi, nơi mà CO2 được giải phóng vào trong khí thở ra. Trong các mô, carbonic anhydrase chứa kẽm giúp chuyển CO2 thành carbonic acid:
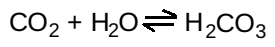
Carbonic acid sẽ ion hóa tự phát thành bicarbonate (đệm chính của máu) và H+:
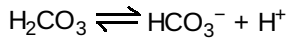
H+ được tạo ra bởi cặp phản ứng này sẽ đóng góp vào sự làm giảm pH. Sự chênh lệch pH này (các phổi có một pH cao và các mô có một pH thấp) sẽ giúp giải phóng O2 ở các mô ngoại vi và sự tích trữ O2 trong phổi. Vì thế, ái tính với oxygen của phân tử hemoglobin đáp ứng với các sự dịch chuyển nhỏ trong pH giữa các phổi và các mô tiêu thụ oxygen, làm cho hemoglobin trở thành một chất vận chuyển oxygen hiệu quả hơn.
b. Cơ chế của hiệu ứng Bohr: Hiệu ứng Bohr phản ánh một điều là deoxyhemoglobin có một ái tính cao hơn với H+ so với oxyhemoglobin. Điều này là do các nhóm chức năng có thể bị ion hóa như các chuỗi bên của histidine đặc hiệu có một pKa cao hơn ở dạng deoxyhemoglobin so với oxyhemoglobin. Vì thế, một sự tăng lên trong nồng độ của H+ (làm giảm pH) sẽ làm cho các nhóm này trở nên được proton hóa (tích điện) và có thể hình thành nên các liên kết ion (các cầu muối). Những liên kết này dành ưu tiên ổn định deoxyhemoglobin, tạo ra một sự giảm trong ái tính với oxygen. (Chú ý: Do đó, hemoglobin là một đệm máu quan trọng).
Hiệu ứng Bohr có thể được biểu diễn đơn giản như sau:
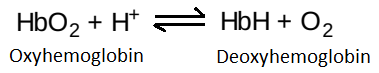
trong đó một sự tăng lên trong nồng độ H+ (hay một giá trị pO2 thấp hơn) sẽ làm dịch chuyển cân bằng sang bên phải (ưu tiên dạng deoxyhemoglobin), ngược lại một sự tăng lên trong giá trị pO2 (hay một sự giảm trong nồng độ H+) sẽ làm dịch chuyển cân bằng sang bên trái.
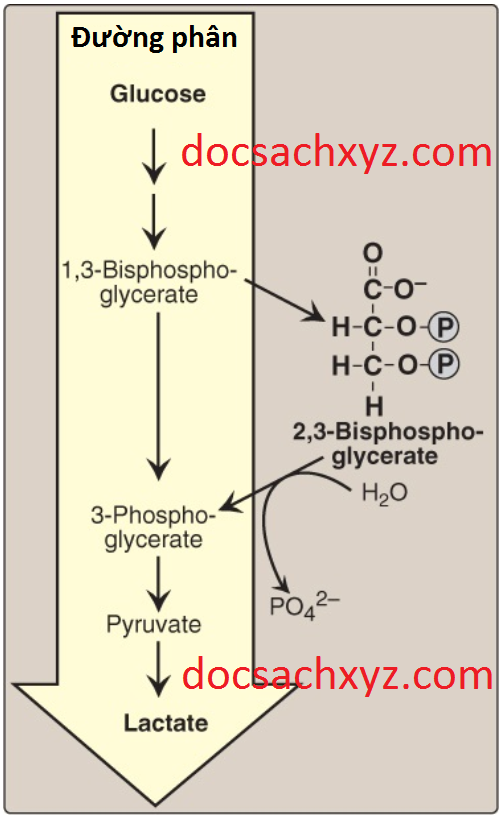
3. 2,3-BPG ảnh hưởng đến ái tính của oxygen: 2,3-BPG là một chất điều hòa quan trọng trong liên kết của O2 với hemoglobin. Nó là phosphate hữu cơ dồi dào nhất trong các tế bào hồng cầu, nơi mà nồng độ của nó xấp xỉ nồng độ của hemoglobin. 2,3-BPG được tổng hợp từ một trung gian của con đường đường phân (Hình 10).
a. 2,3-BPG liên kết với deoxyhemoglobin: 2,3-BPG làm giảm ái tính đối với oxygen của hemoglobin bằng cách liên kết với deoxyhemoglobin nhưng không liên kết với oxyhemoglobin. Sự ưu tiên liên kết này giúp làm ổn định cấu hình T của hemoglobin. Tác động của việc liên kết 2,3-BPG có thể được biểu diễn đơn giản như sau:
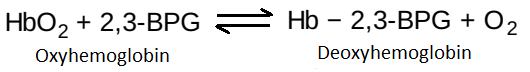
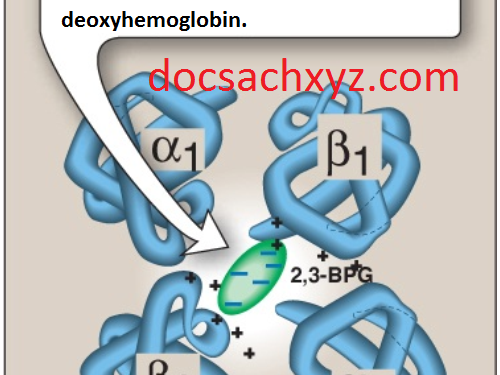
b. Vị trí liên kết 2,3-BPG: Một phân tử 2,3-BPG liên kết vào trong một khe được hình thành bởi 2 chuỗi β-globin, ở trung tâm của tetramer deoxyhemoglobin (Hình 11). Khe này chứa một vài amino acids tích điện dương giúp hình thành nên các liên kết ion với các nhóm phosphate tích điện âm của 2,3-BPG. (Chú ý: Sự thay thế của một trong số các amino acids này có thể hình thành nên các biến thể của hemoglobin với một ái tính với oxygen cao bất thường mà có thể được đền bù bởi sự tăng sản xuất tế bào hồng cầu (sự tăng sinh hồng cầu)). Sự oxygen hóa của hemoglobin làm hẹp khe và làm cho 2,3-BPG được giải phóng ra.

c. Sự dịch chuyển của đường cong phân ly oxygen: Hemoglobin mà từ đó 2,3-BPG được giải phóng ra thì sẽ có ái lực với oxygen cao. Tuy nhiên, sự xuất hiện của 2,3-BPG làm giảm đáng kể ái tính với oxygen của hemoglobin, làm dịch chuyển đường cong phân ly oxygen sang bên phải (Hình 12). Sự giảm ái tính này làm cho hemoglobin giải phóng O2 một cách hiệu quả ở các áp lực riêng phần oxygen tại các mô.
d. Các mức 2,3-BPG trong thiếu oxygen hay thiếu máu mạn tính: Nồng độ của 2,3-BPG trong các tế bào hồng cầu tăng trong đáp ứng với thiếu oxy máu mạn tính như trong bệnh phổi tắc nghẽn mạn tính (COPD) như khí phế thũng hay ở độ cao cao so với mực nước biển, nơi mà pO2 thì thấp và hemoglobin tuần hoàn có thể khó nhận đủ oxygen. Mức nội bào của 2,3-BPG thì cũng tăng trong thiếu máu mạn tính, trong đó có ít tế bào hồng cầu hơn bình thường để đáp ứng nhu cầu oxygen của cơ thể. Sự tăng lên của các mức 2,3-BPG sẽ làm giảm ái tính đối với oxygen của hemoglobin, cho phép sự giải phóng nhiều hơn O2 trong các mao mạch của mô (xem Hình 12).
e. 2,3-BPG trong máu truyền: 2,3-BPG thì cần thiết cho chức năng vận chuyển oxygen bình thường của hemoglobin. Tuy nhiên, máu tích trữ trong ngân hàng máu dần dần trở nên cạn kiệt 2,3-BPG. Kết quả là máu tích trữ sẽ cho thấy một ái tính với oxygen cao bất thường và không thể giải phóng O2 liên kết của nó một cách thích hợp trong các mô. Vì thế, sự suy giảm của hemoglobin trong nồng độ 2,3-BPG sẽ đóng vai trò như là một “bẫy” oxygen hơn là một hệ thống vận chuyển oxygen. Các tế bào hồng cầu được truyền thì có khả năng hồi phục sự cạn kiệt 2,3-BPG trong 6 đến 24 giờ. Tuy nhiên, những bệnh nhân mắc bệnh nặng có thể bị tổn thương nếu truyền lượng lớn máu cạn kiệt 2,3-BPG như vậy. Vì thế, máu tích trữ được xử lý bằng một dung dịch hồi phục (“rejuvenation” solution) giúp hồi phục 2,3-BPG một cách nhanh chóng. (Chú ý: Dung dịch hồi phục cũng giúp hồi phục ATP mất trong suốt quá trình lưu trữ).
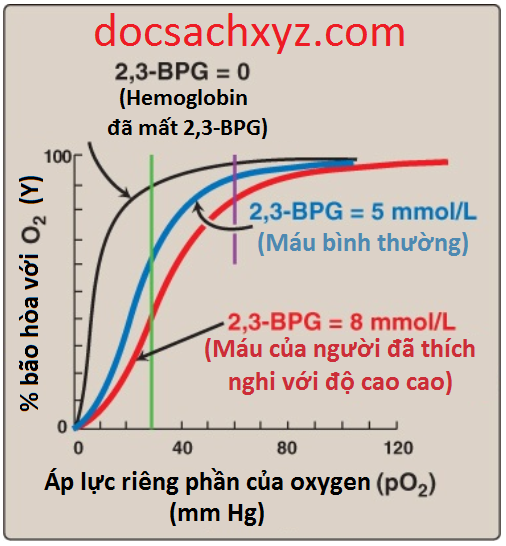
Ứng dụng lâm sàng 1: 2,3-BPG giải phóng oxygen vào trong các mô
Để hình dung về vai trò của 2,3-BPG trong việc giải phóng oxygen vào trong các mô thì trước tiên chúng ta hãy xem xét 2 điều kiện khác nhau: một người sống ở mực nước biển với mức 2,3-BPG là 5 mmol/L và đi lên một độ cao cao hơn mực nước biển, nơi mà pO2 thấp và một người khác sống ở một nơi có độ cao cao so với mực nước biển và có sự đền bù bằng việc tăng mức 2,3-BPG lên đến 8 mmol/L. Hemoglobin trong các phổi của người có mức 2,3-BPG 5 mmol/L sẽ được bão hòa oxygen hoàn toàn ở mực nước biển (Hình 12). Trong các mô, hemoglobin của họ sẽ bão hòa oxygen ở mức khoảng 60% (được thể hiện bởi đường màu xanh lá cây), do đó, giúp phân phối khoảng 40% oxygen liên kết đến các mô của họ. Ở độ cao cao với mức 2,3-BPG 5 mmol/L thì hemoglobin bão hòa của cùng một người chỉ vào khoảng 90% ở tại phổi (được thể hiện bởi đường màu tím), vì thế, oxygen phân phối đến các mô của họ là khoảng 30%. Tuy nhiên, người sống ở độ cao cao sẽ có một sự thích nghi để có hemoglobin với mức 8 mmol/L 2,3-BPG. Đường cong liên kết oxygen dịch chuyển sang bên phải. Sự bão hòa oxygen trong các phổi bây giờ chỉ khoảng 80% (được thể hiện bởi đường màu tím) và sự bão hòa oxygen trong các mô là khoảng 40% (được thể hiện bởi đường màu xanh lá cây), do đó, cung cấp một sự phân phối tương đương khoảng 40% oxygen liên kết đến các mô nhờ sự tăng lên trong mức 2,3-BPG. Sự thay đổi trong ái tính liên kết với oxygen đã cho phép một sự phân phối 40% oxygen tương đương đến các mô.
4. Liên kết với CO2: Hầu hết CO2 được sản xuất trong chuyển hóa thì được hydrat hóa và được vận chuyển dưới dạng ion bicarbonate (xem Hình 13). Tuy nhiên, một số CO2 thì được vận chuyển dưới dạng liên kết carbamate với các nhóm amino tận cùng của hemoglobin (hình thành nên carbaminohemoglobin như trong Hình 8), có thể được biểu diễn đơn giản như sau:

Sự liên kết của CO2 giúp ổn định dạng T hay dạng deoxy của hemoglobin, kết quả là tạo ra sự giảm trong ái tính với oxygen của chúng và một sự dịch chuyển sang bên phải trong đường cong phân ly oxygen. Trong các phổi, CO2 phân ly từ hemoglobin và được giải phóng vào trong hơi thở.
5. Liên kết CO: Carbon monoxide (CO) liên kết chặt chẽ (nhưng thuận nghịch) với sắt của hemoglobin, hình thành nên carboxyhemoglobin. Khi CO liên kết với một hoặc nhiều hơn trong 4 vị trí của heme thì hemoglobin sẽ dịch chuyển sang cấu hình dạng R, làm cho các ví trí heme còn lại liên kết O2 với ái tính cao. Điều này làm dịch chuyển đường cong phân ly oxygen sang bên trái và thay đổi hình dạng sigmoid bình thường hướng về dạng hyperbol. Kết quả là hemoglobin bị ảnh hưởng không thể giải phóng O2 đến các mô (Hình 14). (Chú ý: Ái tính của hemoglobin đối với CO thì gấp 220 lần so với O2. Kết quả là, ngay cả các nồng độ nhỏ của CO trong môi trường cũng có thể tạo ra các nồng độ gây độc của carboxyhemoglobin trong máu. Ví dụ, sự tăng mức CO được tìm thấy trong máu của những người hút thuốc lá. Ngộ độc CO là do sự kết hợp của thiếu oxy mô và sự tổn thương trực tiếp qua trung gian CO ở cấp độ tế bào). Ngộ độc CO được điều trị với 100% O2 ở áp lực cao (liệu pháp oxy cao áp), điều này làm thúc đẩy sự phân ly của CO khỏi hemoglobin. (Chú ý: CO cũng ức chế Complex IV của chuỗi truyền electron). Khí nitric oxide (NO) cũng được mang bởi hemoglobin. NO là một chất giãn mạch mạnh. Nó có thể được nhận vào (bảo vệ bởi) hoặc giải phóng từ các tế bào hồng cầu, bằng cách đó điều chỉnh mức độ sẵn có của NO và tác động đến đường kính mạch máu.
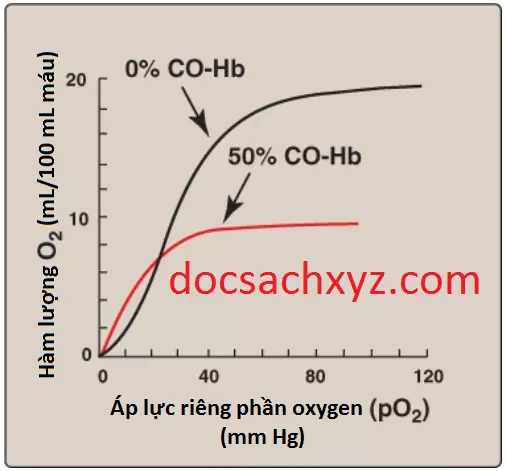
CO-Hb = carboxyhemoglobin (carbon monoxyhemoglobin).
F. Các hemoglobins thiểu số
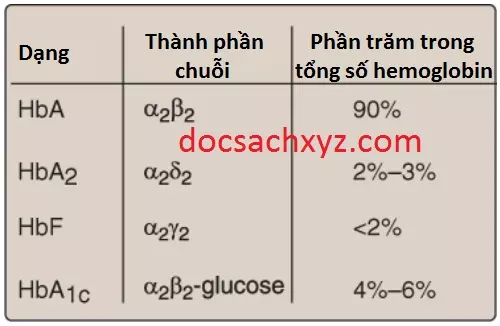
Sẽ rất quan trọng khi nhớ rằng HbA của người chỉ là một trong số các thành viên của một họ các proteins liên quan về mặt cấu trúc và chức năng, được gọi là hemoglobins (Hình 14). Mỗi trong số các protein mang oxygen này là một tetramer, bao gồm 2 chuỗi polypeptide α-globin (hay tương tự α-globin) và 2 chuỗi polypeptide β-globin (hay tương tự β-globin). HbF được tổng hợp trong suốt quá trình phát triển của thai nhi nhưng chỉ xuất hiện khoảng dưới 2% trong hemoglobin của máu người trưởng thành. HbF được tập trung trong các tế bào hồng cầu được gọi là các tế bào F. HbA2 cũng được tổng hợp ở người trưởng thành mặc dù ở các mức thấp so với HbA. HbA có thể được chỉnh sửa bởi liên kết cộng hóa trị với một hexose (HbA1c).
1. Hemoglobin thai nhi: HbF là một tetramer bao gồm 2 chuỗi α tương tự với các chuỗi được tìm thấy trong HbA, cùng với 2 chuỗi γ (α2γ2, xem Hình 15). Các chuỗi γ là các thành viên của họ gen β-globin.
a. Sự tổng hợp HbF trong suốt quá trình phát triển: Trong tháng đầu tiên sau khi thụ thai, các hemoglobins của phôi thai như Hb Gower 1, bao gồm 2 chuỗi chuỗi zeta (ζ) tương tự α và 2 chuỗi epsilon (ε) tương tự β (ζ2ε2), được tổng hợp bởi túi noãn hoàng của phôi thai. Trong tuần thứ 5 của thai kỳ, vị trí tổng hợp globin được dịch chuyển, đầu tiên là đến gan và sau đó là đến tủy xương và sản phẩm chủ yếu là HbF. HbF là hemoglobin chính được tìm thấy trong thai nhi và trẻ mới sinh, chiếm khoảng 60% tổng lượng hemoglobin trong các tế bào hồng cầu trong suốt 6 tháng cuối của đời sống thai nhi (Hình 16). Sự tổng hợp HbA bắt đầu trong tủy xương quanh tháng thứ tám của thai kỳ và dần dần thay thế cho HbF. Hình 16 cho thấy sự sản xuất tương đối của mỗi loại chuỗi hemoglobin trong suốt đời sống thai nhi và sau khi sinh.
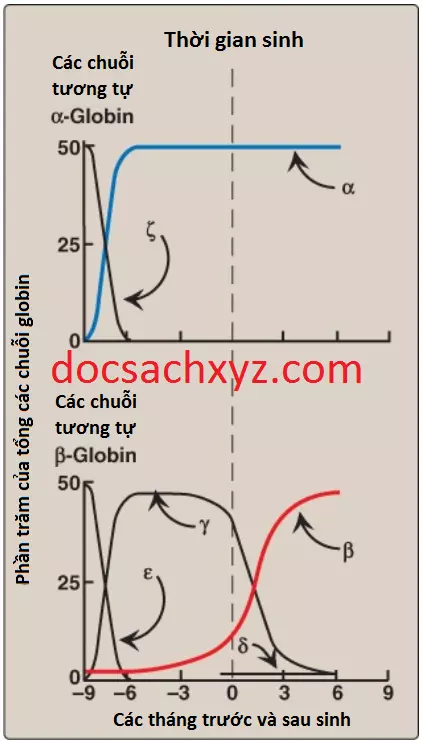
b. 2,3-BPG liên kết với HbF: Dưới các điều kiện sinh lý, HbF có một ái lực đối với oxygen cao hơn so với HbA là do HbF liên kết yếu với 2,3-BPG. (Chú ý: Các chuỗi γ-
globin của HbF thiếu một số amino acids tích điện dương mà chịu trách nhiệm cho liên kết với 2,3-BPG trong các chuỗi β-globin). Bởi vì 2,3-BPG đóng vai trò là làm giảm ái tính đối với oxygen của hemoglobin nên sự tương tác giữa 2,3-BPG và HbF yếu hơn sẽ làm cho ái tính với oxygen của HbF cao hơn so với HbA. Ngược lại, nếu như cả HbA và HbF bị tách khỏi 2,3-BPG của chúng thì chúng sẽ có ái tính với oxygen tương tự nhau. Ái tính với oxygen cao hơn của HbF tạo điều kiện cho sự vận chuyển của O2 từ tuần hoàn của mẹ qua nhau thai đến các tế bào hồng cầu của thai nhi.
2. Hemoglobin A2: HbA2 là một thành phần thiểu số của hemoglobin bình thường ở người trưởng thành, xuất hiện lần đầu tiên không lâu trước khi sinh và cuối cùng đóng góp vào khoảng 2% tổng lượng hemoglobin. Nó gồm 2 chuỗi α-globin và 2 chuỗi δ-globin (α2δ2; xem Hình 15).
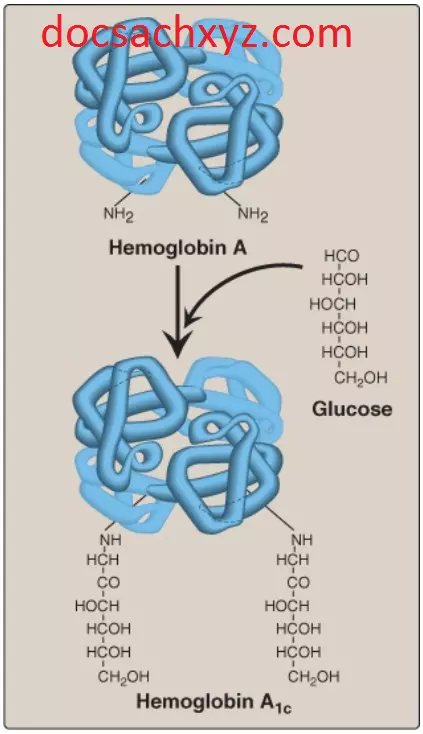
3. Hemoglobin A1c: Dưới các điều kiện sinh lý, các phân tử đường, chủ yếu là glucose, được thêm vào HbA mà không có sự xúc tác của enzyme trong một quá trình được gọi là sự đường hóa. Mức độ của sự đường hóa thì phụ thuộc vào nồng độ của hexose huyết tương. Dạng dồi dào nhất của hemoglobin được đường hóa là HbA1c. Trong HbA1c, các gốc glucose được nối vào các nhóm amino của đầu N thuộc các valines trong các chuỗi β-globin (Hình 17). Lượng HbA1c tăng lên được phát hiện trong các tế bào hồng cầu của các bệnh nhân tiểu đường, bởi vì HbA của chúng có tiếp xúc với các nồng độ glucose cao hơn trong suốt đời sống 120 ngày của những tế bào hồng cầu này.
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/cau-truc-cua-cac-phan-tu-proteins/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!