III. Sự dị hóa khung carbon của amino acid
F. Các amino acids khác mà giúp hình thành nên succinyl CoA
Sự thoái hóa của valine, isoleucine và threonine cũng tạo ra sự hình thành của succinyl CoA, một trung gian của chu trình TCA và là hợp chất của quá trình tân tạo đường. (Chú ý: Nó được chuyển hóa thành pyruvate).
1. Valine và isoleucine: Các amino acids này là các amino acids phân nhánh (branched-chain amino acids – BCAAs) mà tạo thành propionyl CoA, là chất được chuyển thành methylmalonyl CoA và sau đó thành succinyl CoA bởi các phản ứng cần biotin và vitamin B12.
2. Threonine: Amino acid này được dehydrate hóa thành α-ketobutyrate, là chất được chuyển thành propionyl CoA và sau đó thành succinyl CoA. Do đó, propionyl CoA được tạo thành bởi sự dị hóa của các amino acids methionine, valine, isoleucine và threonine. (Chú ý: Propionyl CoA cũng được tạo thành bởi sự oxy hóa của các acids béo có số lẻ carbon, xem lại phần chuyển hóa chất béo nhé).
G. Các amino acids mà hình thành nên acetyl CoA hoặc acetoacetyl CoA
Tryptophan, leucine, isoleucine và lysine hình thành nên acetyl CoA hoặc acetoacetyl CoA một cách trực tiếp mà không có pyruvate đóng vai trò như là một trung gian. Như đã được lưu ý trước đây, phenylalanine và tyrosine cũng tạo ra acetoacetate trong suốt quá trình dị hóa của chúng (xem Hình 7, phần 1). Vì thế, có tổng cộng 6 amino acids tạo thể ketone một phần và toàn phần.
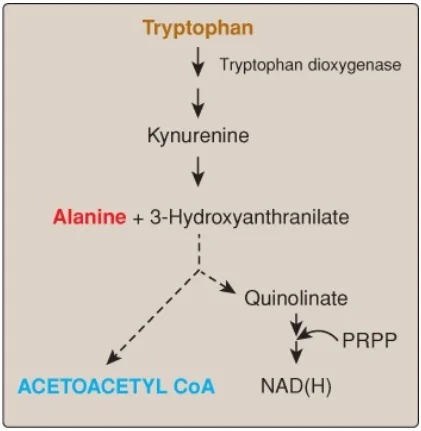
1. Tryptophan: Amino acid này thì vừa tạo đường, vừa tạo thể ketone bởi vì sự dị hóa của nó thu được alanine và acetoacetyl CoA (Hình 10). (Chú ý: Quinolinate từ sự dị hóa tryptophan được sử dụng trong sự tổng hợp của nicotinamide adenine dinucleotide [NAD]).
2. Leucine: Amino acid này thì hoàn toàn tạo thể ketone bởi vì sự dị hóa của nó thu được acetyl CoA và acetoacetate (Hình 11). Hai phản ứng đầu tiên trong sự dị hóa của leucine và các BCAAs khác, là isoleucine và valine, được xúc tác bởi các enzymes mà sử dụng tất cả ba BCAAs (hoặc các dẫn xuất của chúng) như là các cơ chất (xem phần H. bên dưới).
3. Isoleucine: Amino acid này thì vừa tạo đường, vừa tạo thể ketone bởi vì sự chuyển hóa của nó thu được acetyl CoA và propionyl CoA.
4. Lysine: Amino acid này thì hoàn toàn tạo thể ketone và độc đáo trong việc cả hai nhóm amino của nó đều không trải qua sự chuyển nhóm amino như là bước đầu tiên trong quá trình dị hóa. Lysine cuối cùng được chuyển thành acetoacetyl CoA.
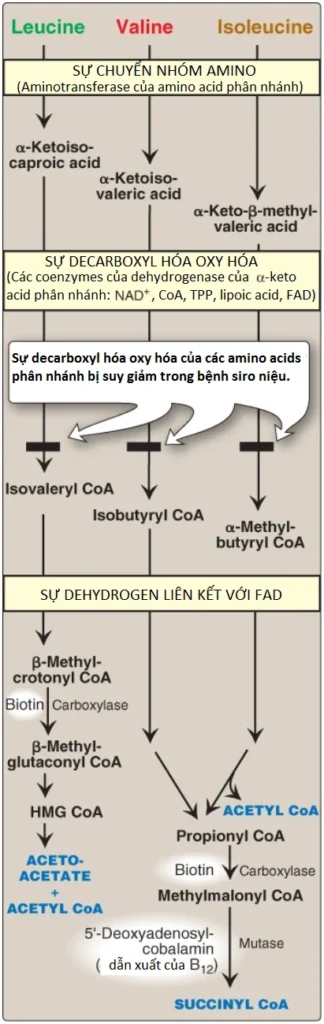
H. Sự thoái hóa amino acid phân nhánh
Các BCAAs, isoleucine, leucine và valine là các amino acids thiết yếu. Ngược lại với các amino acids khác, chúng được dị hóa chủ yếu bởi các mô ngoại vi (đặc biệt là cơ), chứ không phải là bởi gan. Bởi vì các nhóm amino acids này có một chặng thoái hóa tương tự nhau nên sẽ thuận tiện hơn khi mô tả chúng như là một nhóm chung (xem Hình 11).
1. Sự chuyển nhóm amino: Sự chuyển các nhóm amino của tất cả ba BCAAs này thành α-ketoglutarate được xúc tác bởi một enzyme cần vitamin B6, là aminotransferase của amino acid phân nhánh (branched-chain amino acid aminotransferase) mà được biểu hiện chủ yếu trong cơ xương.
2. Sự decarrboxyl oxy hóa: Sự loại bỏ nhóm carboxyl của các α-keto acids có nguồn gốc từ leucine, valine và isoleucine được xúc tác bởi một phức hợp đa enzyme, là phức hợp dehydrogenase của alpha-keto acid phân nhánh (branched-chain α-keto acid dehydrogenase – BCKD). Một sự thiếu hụt về mặt enzyme trong phức hợp này sẽ gây ra bệnh siro niệu (maple syrup urine disease – MSUD) (xem Hình 11). Phức hợp này sử dụng thiamine pyrophosphate, lipoic acid, flavine adenine dinucleotide oxy hóa (FAD), NAD+ và CoA như là các coenzyme của nó và tạo ra NADH. (Chú ý: Phản ứng này thì tương tự với sự chuyển đổi pyruvate thành acetyl CoA (acetyl coenzyme A) bởi phức hợp pyruvate dehydrogenase [PDH] và α-ketoglutarate thành succinyl CoA bởi phức hợp α-ketoglutarate dehydrogenase. Thành phần dihydrolipoyl dehydrogenase [Enzyme 3, hay E3] thì tương tự với nhau trong tất cả ba phức hợp).
3. Sự dehydrogen hóa: Sự oxy hóa của các sản phẩm được hình thành trong phản ứng BCKD tạo thành các dẫn xuất acyl CoA không bão hòa α,β (α,β-unsaturated acyl CoA) và FADH2. Các phản ứng này thì tương tự với sự dehydrogen hóa liên kết với FAD trong sự oxy hóa β của các acids béo. (Chú ý: Sự thiếu hụt trong dehydrogenase đặc hiệu cho isovaleryl CoA gây ra các vấn đề thần kinh và có liên quan đến một “mùi hôi chân” [“sweaty feet” odor] trong các dịch cơ thể).
4. Các sản phẩm cuối cùng: Sự dị hóa của isoleucine cuối cùng tạo thành acetyl CoA và succinyl CoA, khiến nó trở thành amino acid vừa tạo đường vừa tạo thể ketone. Valine tạo thành succinyl CoA và là amino acid tạo đường. Leucine là amino acid tạo thể ketone, được chuyển hóa thành acetoacetate và acetyl CoA. Ngoài ra, NADH và FADH2 được sản xuất lần lượt trong các phản ứng decarboxyl và dehydrogen. (Chú ý: Sự dị hóa BCAA cũng tạo thành glutamine và alanine mà được tổng hợp và đưa vào trong máu từ cơ).
IV. Folic acid và chuyển hóa amino acid
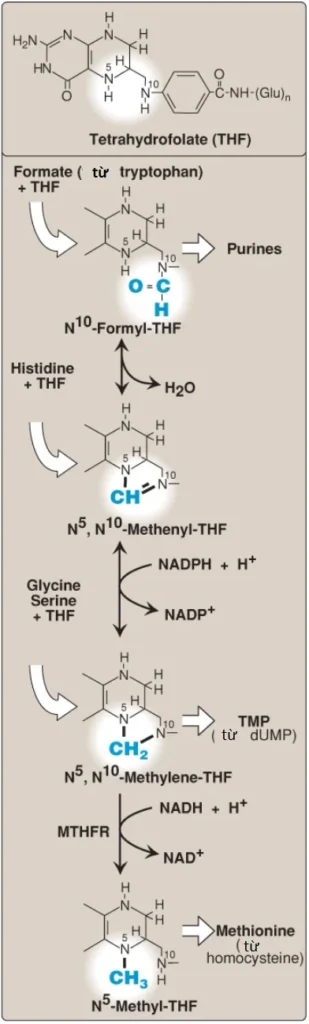
Một số con đường tổng hợp cần sự bổ sung của các nhóm 1 carbon mà tồn tại ở các dạng oxy hóa khác nhau, bao gồm formyl, methenyl, methylene và methyl. Các nhóm 1 carbon này có thể được chuyển từ các hợp chất mang như THF và SAM đến các cấu trúc chuyên biệt mà được tổng hợp hoặc được chỉnh sửa. “Hồ 1 carbon” (one-carbon pool) đề cập đến các đơn vị 1 carbon mà liên kết với nhóm các chất mang này. (Chú ý: CO2, có nguồn gốc từ bicarbonate [HCO3–], được mang bởi vitamin biotin, là một nhóm phụ (prosthetic group) cho hầu hết các phản ứng carboxyl hóa nhưng không được xem là một thành viên của “hồ 1 carbon”. Các khiếm khuyết trong khả năng thêm hoặc loại bỏ biotin khỏi carboxylases gây ra nhiều tình trạng thiếu hụt carboxylase. Điều trị là sự bổ sung biotin).
A. Folic acid và sự chuyển hóa một carbon
Dạng hoạt động của folic acid, THF, được tạo ra từ folate bởi dihydrofolate reductase trong một phản ứng 2 bước mà cần 2 nicotinamide adenine dinucleotide phosphate (NADPH). Đơn vị một carbon được mang bởi THF sẽ liên kết với N5 hoặc N10 hoặc cả N5 và N10. Hình 12 cho thấy các cấu trúc của các thành viên khác nhau thuộc họ THF và các sự chuyển đổi qua lại của chúng và đồng thời cũng chỉ ra các nguồn của các đơn vị một carbon và các phản ứng tổng hợp mà trong đó các thành viên chuyên biệt tham gia. (Chú ý: Sự thiếu hụt folate biểu hiện như là một thiếu máu hồng cầu khổng lồ bởi vì sự giảm có mặt sẵn của purines và của thymidine monophosphate mà cần cho sự tổng hợp DNA).
V. Sự sinh tổng hợp của các amino acids không thiết yếu
Các amino acid không thiết yếu được tổng hợp từ các trung gian của quá trình chuyển hóa hoặc như trong trường hợp của tyrosine và cysteine, lần lượt là từ các amino acids thiết yếu phenylalanine và methionine. Các phản ứng tổng hợp đối với các amino acids không thiết yếu được mô tả bên dưới và được tổng hợp trong bài viết sau. (Chú ý: Một số amino acids được tìm thấy trong các proteins, như hydroxyproline và hydroxylysine là được sản xuất bởi sự chỉnh sửa sau dịch mã [sau khi tích hợp vào trong một protein] của các amino acids tiền thân [cha] của chúng).
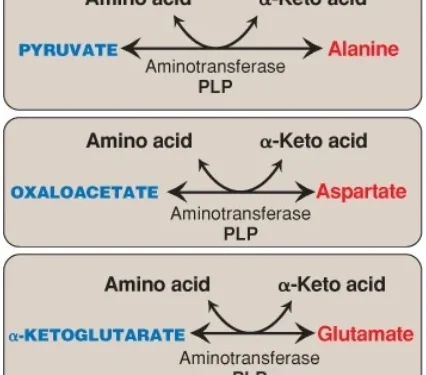
A. Sự tổng hợp từ các α-keto acids
Alanine, aspartate và glutamate được tổng hợp bằng sự chuyển của một nhóm amino lần lượt đến các α-keto acids pyruvate, oxaloacetate và α-ketoglutarate. Các phản ứng chuyển nhóm amino này (Hình 13) là trực tiếp nhất trong số các con đường sinh tổng hợp. Glutamate thì đặc biệt bởi vì nó cũng có thể được tổng hợp bởi sự đảo ngược của quá trình khử amino oxy hóa, được xúc tác bởi glutamate dehydrogenase, khi các mức amoniac cao (xem các bài viết trước).

B. Sự tổng hợp bởi sự amide hóa
1. Glutamine: Amino acid này, chứa một liên kết amide với amoniac ở γ-carboxyl, được hình thành từ glutamate và amoniac bởi glutamine synthetase (xem lại bài viết trước). Phản ứng được điều khiển bởi sự thủy phân ATP. Ngoài sản xuất glutamine cho sự tổng hợp protein, phản ứng cũng đóng vai trò như là một cơ chế chính cho sự vận chuyển của amoniac ở một dạng không gây độc (xem bài viết trước về chuyển hóa amoniac).
2. Asparagine: Amino acid này, chứa một liên kết amide với amoniac ở β-carboxyl, được hình thành từ aspartate bởi asparagine synthetase, sử dụng glutamine như là chất cho amide. Giống như sự tổng hợp glutamine, phản ứng cần ATP và có một cân bằng theo hướng tổng hợp amide.
C. Proline
Glutamate thông qua glutamate semialdehyde, được chuyển thành proline bởi các phản ứng đóng vòng và khử. (Chú ý: Semialdehyde cũng có thể được chuyển nhóm amino thành ornithine).
D. Serine, glycine và cysteine
Các con đường tổng hợp các amino acids này có kết nối với nhau.
1. Serine: Amino acid này có nguồn gốc từ 3-phosphoglycerate, một trung gian của quá trình đường phân (xem bài viết trước), là chất được oxy hóa đầu tiên thành 3-phosphopyruvate và sau đó được chuyển nhóm amino thành 3-phosphoserine. Serine được hình thành bởi sự thủy phân của phosphate ester. Serine cũng có thể được hình thành từ glycine thông qua sự chuyển của một nhóm hydroxymethyl bởi serine hydroxymethyltransferase sử dụng N5,N10-MTHF như là chất cho một carbon (xem Hình 6A, phần 1). (Chú ý: Selenocysteine [Sec], amino acid được mã hóa về mặt di truyền thứ 21, được tổng hợp từ serine và selenium, trong khi serine được nối với RNA vận chuyển. Sec được tìm thất trong khoảng 25 protein của người bao gồm cả glutathione peroxidase [xem bài viết trước] và thioredoxin reductase [xem các bài viết sau]).
2. Glycine: Amino acid này được tổng hợp từ serine bởi sự loại bỏ của một nhóm hydroxymethyl, cũng bởi serine hydroxymethyltransferase (xem Hình 6A, phần 1). THF là chất nhận một carbon.
3. Cysteine: Amino acid này được tổng hợp bởi hai phản ứng kế tiếp mà trong đó Hcy kết hợp với serine, hình thành nên cystathionine, mà cuối cùng được thủy phân thành α-ketobutyrate và cysteine (xem Hình 8, phần 1). (Chú ý: Hcy có nguồn gốc từ methionine, như được mô tả trong các bài viết sau. Bởi vì methionine là một amino acid thiết yếu nên sự tổng hợp cysteine cần sự hấp thu methionine đầy đủ từ chế độ ăn).
E. Tyrosine
Tyrosine được hình thành từ phenylalanine bởi PAH (xem bài viết trước). Phản ứng cần oxygen phân tử và coenzyme BH4, được tổng hợp từ guanosine triphosphate. Một nguyên tử của oxygen phân tử trở thành nhóm hydroxyl của tyrosine và nguyên tử oxygen còn lại bị khử thành nước. Trong suốt phản ứng, BH4 được oxy hóa thành dihydrobiopterin (BH2). BH4 được tái tạo từ BH2 bởi dihydropteridine reductase cần NADH. Tyrosine, giống như cysteine, được hình thành từ một amino acid thiết yếu và vì thế, nó chỉ không thiết yếu trong sự có mặt đầy đủ của phenylalanine trong chế độ ăn.
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/amino-acids-su-thoai-hoa-va-su-tong-hop-phan-1/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!