IV. Sự loại bỏ nitrogen từ các amino acids
Sự có mặt của nhóm α-amino giúp giữ các amino acids không bị thoái hóa oxy hóa. Loại bỏ nhóm α-amino là điều cần thiết để tạo ra năng lượng từ bất kỳ amino acid nào và là một bước bắt buộc trong quá trình dị hóa của tất cả các amino acids. Một khi bị loại bỏ, nitrogen này có thể được tích hợp vào trong các hợp chất khác hoặc được bài tiết dưới dạng urea, với các khung carbon sẽ được chuyển hóa. Phần này sẽ mô tả quá trình chuyển nhóm amino và sự khử amino oxy hóa, các phản ứng mà cuối cùng cung cấp amoniac và aspartate, hai nguồn nitrogen của urea.
A. Sự chuyển nhóm amino: chuyển các nhóm amino để hình thành nên glutamate
Bước đầu tiên trong sự dị hóa của hầu hết các amino acids là sự chuyển nhóm α-amino đến α-ketoglutarate (Hình 7), tạo thành một α-keto acid (có nguồn gốc từ amino acid ban đầu) và glutamate (có nguồn gốc tử α-ketoglutarate). Trung gian ketoacid của chu trình citric acid, là α-ketoglutarate, đóng một vai trò quan trọng trong chuyển hóa amino acid bằng cách nhận các nhóm amino từ hầu hết các amino acid, bằng cách đó, trở thành amino acid liên quan về mặt cấu trúc của nó, là glutamate. Glutamate được tạo ra bởi sự chuyển nhóm amino có thể được khử amino oxy hóa (xem phần B. bên dưới) hoặc sử dụng như là một chất cho nhóm amino trong sự tổng hợp của các amino acids không thiết yếu. Sự chuyển các nhóm amino từ một khung carbon đến một khung carbon khác này được xúc tác bởi một họ các enzymes có thể đảo ngược dễ dàng được gọi là aminotransferases (còn được gọi là transaminases). Các enzymes này được tìm thấy trong bào tương và ty thể của các tế bào trên khắp cơ thể. Tất cả các amino acids, với ngoại lệ là lysine và threonine, tham gia vào trong sự chuyển nhóm amino ở một số vị trí trong sự dị hóa của chúng (Chú ý: Hai amino acids này mất các nhóm α-amino của chúng bởi sự khử amino).

1. Tính đặc hiệu cơ chất: Mỗi aminotransferase thì đặc hiệu cho một hoặc nhiều nhất là một vài chất cho nhóm amino. Các aminotransferases được đặt tên theo chất cho nhóm amino đặc hiệu bởi vì chất nhận nhóm amino acid thì hầu như luôn luôn là α-ketoglutarate. Hai phản ứng aminotransferases quan trọng được xúc tác bởi alanine aminotransferase (ALT) và aspartate aminotransferase (AST), như được thể hiện trong Hình 8. Tất cả các aminotransferases đều cần coenzyme pyridoxal phosphate (một dẫn xuất của vitamin B6) mà được liên kết cộng hóa trị với nhóm ε-amino của một gốc lysine đặc hiệu ở vị trí hoạt động của enzyme.
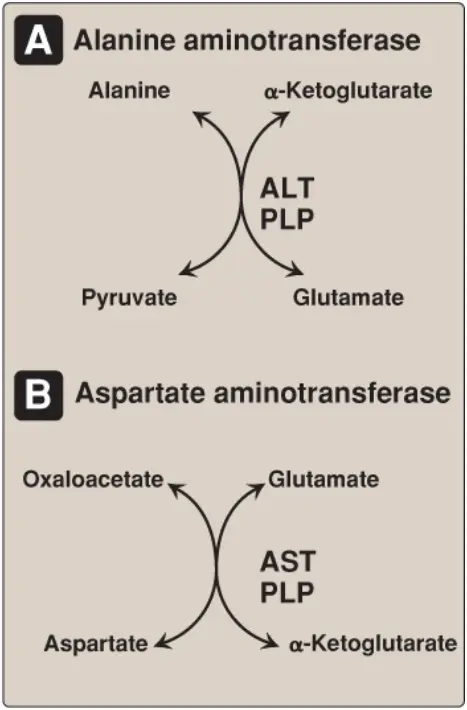
a. Alanine aminotransferase: ALT xuất hiện trong nhiều mô. Enzyme xúc tác cho sự chuyển của nhóm amino của alanine đến α-ketoglutarate, tạo nên sự hình thành của pyruvate và glutamate. Phản ứng thì có thể đảo ngược dễ dàng. Tuy nhiên, trong suốt quá trình dị hóa amino acid, enzyme này (giống như hầu hết aminotransferases) thực hiện chức năng theo hướng tổng hợp glutamate. (Chú ý: Trong thực tế, glutamate đóng vai trò như là một chất thu nitrogen từ hầu hết các amino acids).
b. Aspartate aminotransferase: AST là một ngoại lệ đối với quy luật này (aminotransferases chuyển các nhóm amino để hình thành nên glutamate). Trong suốt quá trình chuyển hóa amino acid, AST chủ yếu chuyển các nhóm amino từ glutamate đến oxaloacetate, hình thành nên lần lượt α-ketoglutarate và aspartate. Aspartate được sử dụng như là một nguồn nitrogen trong chu trình urea. Giống như các các sự chuyển nhóm amino khác, phản ứng AST có thể đảo ngược.
2. Cơ chế: Hình 9 cho thấy các phản ứng của sự chuyển nhóm amino được xúc tác bởi AST. Aminotransferases đóng vai trò bằng cách chuyển nhóm amino của một cơ chất amino acid (glutamate) đến phần pyridoxal của coenzyme để tạo thành pyridoxamine phosphate. Cơ chất amino acid glutamate vì thế được chuyển thành một sản phẩm α-keto acid (α-ketoglutarate). Dạng pyridoxamine của coenzyme sau đó phản ứng với cơ chất α-keto acid (oxaloacetate) để hình thành nên một sản phẩm amino acid (aspartate), cùng lúc đó tái tạo dạng aldehyde ban đầu của coenzyme.

3. Sự cân bằng: Đối với hầu hết các phản ứng chuyển nhóm amino, hằng số cân bằng là gần bằng 1. Điều này cho phép phản ứng thực hiện chức năng trong cả sự thoái hóa amino acid thông qua sự loại bỏ các nhóm α-amino (ví dụ sau khi tiêu thụ một bữa ăn giàu protein) và sự sinh tổng hợp của các amino acid không thiết yếu thông qua sự bổ sung các nhóm amino vào trong các khung carbon của các α-keto acid (ví dụ, khi sự cung cấp các amino acids từ chế độ ăn thì không đủ để đáp ứng các nhu cầu tổng hợp của các tế bào).
4. Giá trị chẩn đoán: Aminotransferases bình thường là các enzyme nội bào, với các mức thấp được tìm thấy trong huyết tương biểu thị cho sự giải phóng của các thành phần tế bào trong suốt quá trình thay thế tế bào bình thường. Các mức aminotransferases tăng lên trong huyết tương cho thấy sự tổn thương đối với các tế bào giàu các enzymes này. Ví dụ, chấn thương vật lý hoặc một quá trình bệnh lý mà có thể gây ra sự phân giải của tế bào, gây ra sự giải phóng của các enzymes nội bào vào trong máu. Hai aminotransferases, AST và ALT, có giá trị chẩn đoán nhất định khi chúng được tìm thấy trong huyết tương.
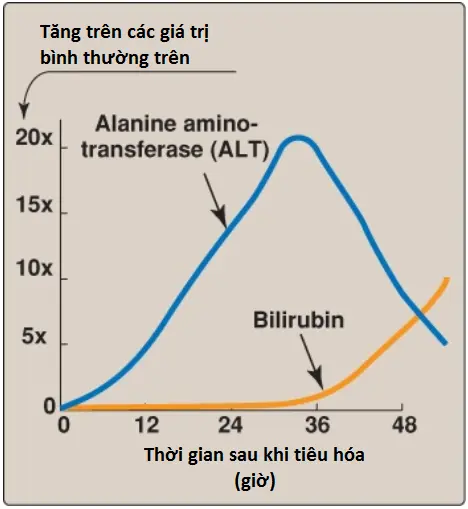
a. Bệnh gan: AST và ALT huyết tương tăng lên trong gần như tất cả các bệnh gan nhưng đặc biệt cao trong các tình trạng mà gây ra sự hoạt tử tế bào rộng rãi, như viêm gan virus nặng, chấn thương do độc tố và trụy tuần hoàn kéo dài. ALT thì đặc hiệu hơn so với AST đối với bệnh gan, nhưng AST thì nhạy cảm hơn bởi vì gan chứa các lượng AST lớn hơn. Các sự đo liên tiếp AST và ALT (các test chức năng gan) thường là hữu ích trong việc xác định tiến triển của tổn thương gan. Hình 10 cho thấy sự giải phóng ban đầu của ALT vào trong máu, được theo sau bởi sự tiêu hóa phải một chất độc đối với gan. (Chú ý: Sự tăng lên trong bilirubin là do tổn thương tế bào gan mà làm giảm sự liên hợp và sự bài tiết bilirubin của gan).
b. Bệnh không phải do gan: Các aminotransferases có thể tăng lên trong các bệnh không phải của gan như các bệnh mà gây ra tổn thương đối với cơ tim hoặc cơ vân. Tuy nhiên, các rối loạn này thường có thể được phân biệt về mặt lâm sàng với bệnh gan nhờ sử dụng thêm các xét nghiệm kiểm tra. Khi tổn thương cơ được nghi ngờ thì các mức huyết tương của creatine kinase, lactate dehydrogenase và myoglobin, ngoài AST và ALT, có thể tăng lên. Các mức nitrogen urea, bilirubin, γ-glutamyl transferase (GGT) và alkaline phosphatase (ALP) máu sẽ trong các khoảng bình thường. Nếu như bệnh xương được nghi ngờ thì các mức ALP sẽ cao hơn so với các mức AST, ALT và GGT một cách không cân xứng.
B. Sự khử amino oxy hóa: sự loại bỏ nhóm amino
Ngược lại với các phản ứng chuyển nhóm amino mà giúp chuyển các nhóm amino thì các phản ứng khử amino oxy hóa sẽ tạo ra sự giải phóng của nhóm amino dưới dạng amoniac tự do (Hình 11). Các phản ứng này xảy ra chủ yếu trong gan và thận. Chúng cung cấp các α-keto acids mà có thể đi vào các con đường chuyển hóa năng lượng trung tâm và amoniac, là một nguồn nitrogen trong sự tổng hợp urea của gan. (Chú ý: Amoniac tồn tại chủ yếu dưới dạng amonium (ion amoni) [NH4+] trong dung dịch nước, nhưng nó ở dạng không ion hóa [NH3] khi mà đi qua các màng).
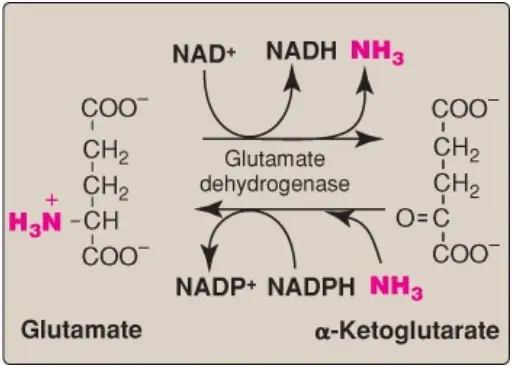
1. Glutamate dehydrogenase: Như được mô tả ở bên trên, các nhóm amino của hầu hết các amino acids cuối cùng được chuyển đến glutamate bằng sự chuyển nhóm amino với α-ketoglutarate. Glutamate là amino acid duy nhất mà trải qua sự khử amino oxy hóa nhanh, một phản ứng được xúc tác bởi glutamate dehydrogenase ([GDH], Hình 11). Vì thế, sự hoạt động theo trình tự của của sự chuyển nhóm amino (gây ra sự chuyển các nhóm amino từ hầu hết các amino cids đến α-ketoglutarate để tạo ra glutamate) và sự khử amino oxy hóa của glutamate đó (tái tạo α-ketoglutarate) cung cấp con đường mà theo đó các nhóm amino của hầu hết các amino acids có thể được giải phóng dưới dạng amoniac.
a. Các coenzymes: GDH, một enzyme ty thể, thì rất đặc biệt vì nó có thể sử dụng nicotinamide adenine dinucleotide (NAD+) hoặc dạng khử được phosphoryl hóa của nó (NADPH) như là một coenzyme (Hình 11). NAD+ được sử dụng chủ yếu trong sự khử amino oxy hóa (sự mất đồng thời của amoniac cùng với sự oxy hóa của khung carbon, như được thể hiện trong Hình 12A), ngược lại, NADPH được sử dụng trong sự amino hóa khử (sự thu đồng thời của ammonia với sự khử của khung carbon, như được thể hiện trong Hình 12B – các bạn sửa “SỰ KHỬ AMINO OXY HÓA” thành “SỰ AMINO HÓA KHỬ” nhé, mình ghi nhầm trong hình).

b. Hướng phản ứng: Hướng của phản ứng phụ thuộc vào các nồng độ tương đối của glutamate, α-ketoglutarate và amoniac và tỷ số của các coenzymes oxy hóa so với khử. Ví dụ, sau khi tiêu hóa một bữa ăn chứa protein, các mức glutamate trong gan được tăng lên và phản ứng diễn ra theo hướng thoái hóa amino acid và sự hình thành của amoniac (Hình 12A). Các mức amoniac cao thì cần để điều hướng phản ứng tổng hợp glutamate.
c. Các chất điều hòa dị lập thể: Guanosine triphosphate là một chất ức chế dị lập thể của GDH, ngược lại, adenosine diphosphate là một chất hoạt hóa. Vì thế, khi các mức năng lượng thấp trong tế bào, sự thoái hóa amino acid bởi GDH thì ở mức cao, tạo điều kiện cho sự sản xuất năng lượng từ các khung carbon có nguồn gốc từ các amino acids.
2. D-amino acid oxidase: D-amino acids được cung cấp bởi chế độ ăn nhưng không được sử dụng trong sự tổng hợp của các protein ở động vật có vú. Tuy nhiên, chúng được chuyển hóa một cách hiệu quả thành các α-keto acids, amoniac và hydrogen peroxide trong các peroxisomes của các tế bào gan và thận bởi D-amino acid oxidase phụ thuộc flavin adenine dinucleotide (DAO). Các α-keto acids có thể đi vào trong các con đường chuyển hóa amino acid thông thường và được tái amino hóa thành các đồng phân dạng L (L-isomers) hoặc được dị hóa để sinh năng lượng. (Chú ý: DAO thoái hóa D-serine, dạng đồng phân của serine mà điều hòa các các thụ cảm thể glutamate type NMDA [N-methyl-D-aspartate]. Tăng hoạt động của DAO thì có liên hệ với việc dễ mắc tâm thần phân liệt. DAO cũng chuyển glycine thành glyoxylate). L-amino acid oxidases được tìm thấy trong nọc độc rắn.
C. Sự vận chuyển ammonia đến gan
Hai cơ chế có sẵn ở người cho sự vận chuyển của amoniac từ các mô ngoại vi đến gan cho sự chuyển đổi thành urea. Cả hai đều quan trọng trong, nhưng không phải là tất cả, cơ vân. Cơ chế đầu tiên sử dụng glutamine synthetase để kết hợp amoniac với glutamate để hình thành nên glutamine, một dạng vận chuyển không gây độc của amoniac (Hình 13). Glutamine được vận chuyển trong máu đến gan, nơi mà nó được phân tách bởi glutaminase thành glutamate và amoniac. Glutamate được khử amino oxy hóa thành amoniac và α-ketoglutarate bởi GDH. Amoniac được chuyển thành urea. Cơ chế vận chuyển thứ hai liên quan đến sự hình thành của alanine bởi sự chuyển nhóm amino của pyruvate được tạo ra từ cả sự đường phân hiếu khí và sự chuyển hóa của succinyl coenzyme A (CoA) được tạo ra bởi sự dị hóa của các amino acid phân nhánh isoleucine và valine. Alanine được vận chuyển trong máu đến gan, nơi mà nó được chuyển nhóm amino bởi ALT thành pyruvate. Pyruvate được sử dụng để tổng hợp glucose, thành phần mà có thể đi vào trong máu và được sử dụng bởi cơ, một con đường được gọi là chu trình glucose-alanine. Sản phẩm glutamate của ALT có thể được khử amino bởi GDH, tạo thành amoniac. Vì thế, cả alanine và glutamine đều mang amoniac đến gan.

Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/amino-acids-su-loai-bo-nitrogen-nito-phan-1/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!





































