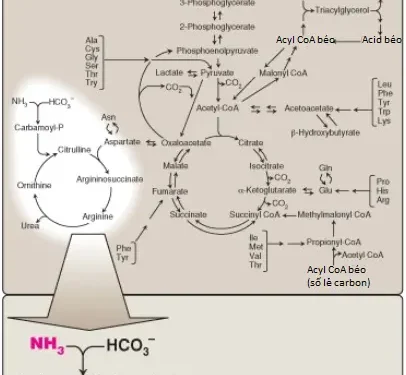
I. Tổng quan
Không giống như các chất béo và carbohydrates, amino acids thì không được tích trữ bởi cơ thể. Nghĩa là, không có protein tồn tại mà chức năng của nó là duy trì một sự cung cấp các amino acids cho sự sử dụng trong tương lai. Vì thế, các amino acids phải được thu lấy từ trong chế độ ăn, được tổng hợp mới hoặc được sản xuất từ sự thoái hóa của protein cơ thể. Bất cứ amino acids nào dư thừa của các quá trình sinh tổng hợp của tế bào thì sẽ được thoái hóa một cách nhanh chóng. Giai đoạn đầu tiên của quá trình dị hóa liên quan với sự loại bỏ các nhóm α-amino (thường bằng sự chuyển nhóm amino và sự khử amino hóa oxy hóa kế tiếp), hình thành nên ammonia (amoniac) và α-keto acids tương ứng, là các khung carbon của các amino acids. Một phần của amoniac tự do được bài tiết trong nước tiểu nhưng hầu hết được sử dụng trong quá trình tổng hợp urea (Hình 1), là chặng quan trọng nhất về lượng cho quá trình loại bỏ nitrogen (nitơ) khỏi cơ thể. Trong giai đoạn thứ hai của sự dị hóa amino acid, sẽ mô tả trong các bài viết sau, các khung carbon của α-keto acids sẽ được chuyển thành các trung gian chung của các con đường chuyển hóa sinh năng lượng. Các hợp chất này có thể được chuyển hóa thành carbon dioxide (CO2) và nước (H2O), glucose, các acid béo, hoặc các thể ketone bởi các con đường chuyển hóa trung tâm đã được mô tả trong các bài viết trước.
II. Sự chuyển hóa nitrogen tổng quan
Sự dị hóa amino acid là một phần của quá trình chuyển hóa lớn hơn của các phân tử chứa nitrogen. Nitrogen đi vào trong cơ thể trong nhiều hợp chất có trong thức ăn, quan trọng nhất là các amino acids chứa trong protein chế độ ăn. Nitrogen rời cơ thể dưới dạng urea, amoniac và các sản phẩm khác có nguồn gốc từ sự chuyển hóa amino acid (như creatinine). Vai trò của các proteins cơ thể trong các sự chuyển dạng này liên quan với 2 khái niệm quan trọng: hồ amino acid (amino acid pool) và sự thay thế protein (protein turnover).
A. Hồ amino acid (amino acid pool)
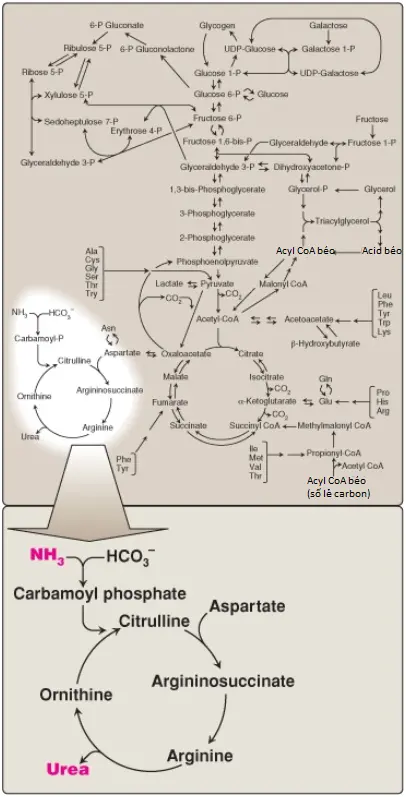
Các amino acids tự do xuất hiện trên khắp cơ thể, như trong các tế bào, máu và các dịch ngoại bào. Vì mục đích của sự bàn luận này, chúng ta sẽ hình dung tất cả các amino acids này như thể là chúng thuộc về một thực thể duy nhất, được gọi là “hồ amino acid” (amino acid pool). Hồ amino acid này được cung cấp bởi 3 nguồn: (1) các amino acids được cung cấp bởi sự thoái hóa của các proteins nội sinh (của cơ thể), hầu hết là được tái sử dụng; (2) các amino acids có nguồn gốc từ các proteins ngoại sinh (chế độ ăn) và (3) các amino acids không thiết yếu được tổng hợp từ các trung gian đơn giản của quá trình chuyển hóa (Hình 2). Ngược lại, hồ amino acid bị cạn kiệt bởi 3 con đường: (1) sự tổng hợp protein của cơ thể, (2) sự tiêu thụ các amino acids dưới dạng các tiền thân của các phân tử nhỏ chứa nitrogen, và (3) sự chuyển đổi của các amino acids thành glucose, glycogen, các acids béo và các thể ketone hay sự oxy hóa thành CO2 + H2O (Hình 2). Mặc dù hồ amino acid thì nhỏ (chứa khoảng 90 đến 100 grams amino acids) so với lượng protein trong cơ thể (khoảng 12 kg ở một nam giới nặng 70 kg) nhưng về mặt khái niệm nó ở trung tâm của sự chuyển hóa nitrogen trên toàn cơ thể.
Ở những người khỏe mạnh, được ăn no thì lượng amino acid đi vào trong hồ amino acid cân bằng với lượng đi ra. Nghĩa là, lượng amino acid chứa trong hồ là hằng định. Hồ amino acid được cho ở trạng thái ổn định và người đó được gọi là ở trong trạng thái cân bằng nitrogen.
B. Sự thay thế protein (protein turnover)
Hầu hết các proteins trong cơ thể thì luôn luôn được tổng hợp và sau đó bị thoái hóa (thay thế), cho phép sự loại bỏ của các proteins bất thường và không cần thiết. Đối với nhiều proteins, sự điều hòa quá trình tổng hợp giúp xác định nồng độ protein trong tế bào, với sự thoái hóa proteins được cho là có một vai trò nhỏ. Đối với các protein khác, tốc độ tổng hợp là cơ bản (về bản chất là hằng định) và các mức trong tế bào của protein được kiểm soát bởi sự thoái hóa chọn lọc.
1. Tốc độ: Ở những người trưởng thành khỏe mạnh, tổng lượng protein trong cơ thể vẫn luôn hằng định bởi vì tốc độ của sự tổng hợp protein thì vừa đủ để thay thế protein mà bị thoái hóa. Quá trình này được gọi là sự thay thế protein (protein turnover), dẫn đến sự thủy phân và tái tổng hợp của 300 đến 400 grams của protein cơ thể mỗi ngày. Tốc độ của sự thay thế protein thay đổi nhiều đối với các proteins khác nhau. Các proteins có đời sống ngắn (ví dụ như nhiều protein điều hòa và protein được cuộn gập sai) thì bị thoái hóa một cách nhanh chóng, có thời gian bán hủy được đo bằng nhiều phút hoặc nhiều giờ. Các proteins có đời sống dài, với thời gian bán hủy được tính bằng nhiều ngày cho đến nhiều tuần, cấu thành nên phần lớn các proteins trong tế bào. Các protein cấu trúc, như collagen, thì ổn định về mặt chuyển hóa và có thời gian bán hủy được tính bằng nhiều tháng hoặc nhiều năm.
2. Sự thoái hóa protein: Có hai hệ thống enzyme chính chịu trách nhiệm cho sự thoái hóa các proteins: hệ thống ubiquitin(Ub)-proteasome phụ thuộc ATP của bào tương và hệ thống enzyme thoái hóa không phụ thuộc ATP của các lysosomes. Các proteasomes thoái hóa có chọn lọc các protein bị tổn thương hoặc có đời sống ngắn. Các lysosomes sử dụng các acid hydrolases để thoái hóa một cách không chọn lọc các proteins nội bào (sự tự thực [autophagy]) và các proteins ngoại bào (sự dị thực [heterophagy]) như các proteins huyết tương mà được đưa vào trong tế bào bằng sự nhập bào.
a. Hệ thống Ubiquitin-proteasome: Các protein được chọn cho sự thoái hóa bởi hệ thống Ub-proteasome bào tương đầu tiên được chỉnh sửa bởi sự liên kết cộng hóa trị của Ub, một protein không phải enzyme có hình cầu nhỏ mà được bảo tồn cao qua các loài tế bào nhân thực. Sự ubiquitin hóa của cơ chất đích xảy ra thông qua liên kết isopeptide của nhóm α-carboxyl của glycine đầu tận C của Ub với nhóm ε-amino của một lysine trong cơ chất protein bởi một quá trình phụ thuộc ATP, xúc tác bởi enzyme và có 3 bước. (Chú ý: Enzyme 1 [E1, một enzyme hoạt hóa] sẽ hoạt hóa Ub, thành phần mà sau đó được chuyển đến E2 [một enzyme liên hợp]. E3 [một ligase] xác định protein được thoái hóa và tương tác với E2-Ub. Có nhiều proteins E3 hơn nhiều so với E1 hoặc E2). Sự bổ sung tiếp theo của 4 hoặc nhiều phân tử Ub hơn vào trong protein đích tạo thành chuỗi polyubiquitin. Các proteins có các đuôi là các chuỗi Ub được nhận ra bởi một phức hợp đại phân tử hình thùng phân giải protein được gọi là proteasome (Hình 3). Proteasome tháo gấp, deubiquitin hóa và cắt protein đích thành các mảnh mà sau đó được thoái hóa nhiều hơn bởi các proteases bào tương thành các amino acids, thành phần mà đi vào trong hồ amino acid. Ub được tái chế. Đáng chú ý là sự thoái hóa có chọn lọc các proteins bởi phức hợp Ub-proteasome (không giống với sự thủy phân đơn giản bởi các enzymes thủy phân protein) cần sự thủy phân ATP.
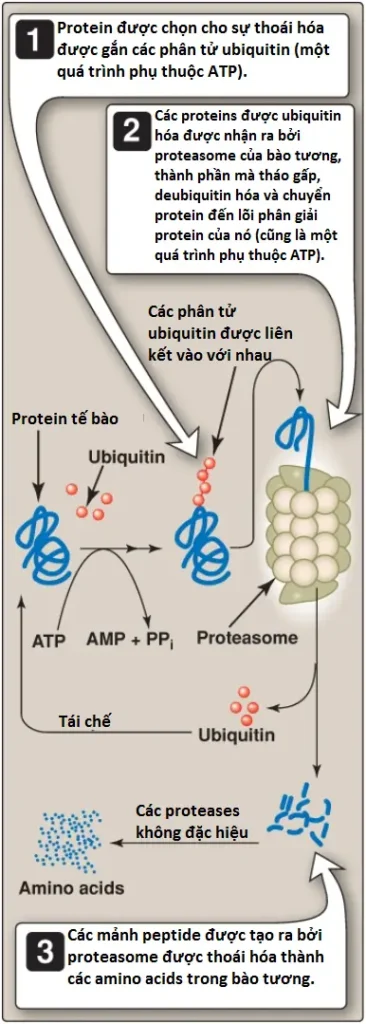
b. Các tín hiệu thoái hóa: Bởi vì các proteins có các thời gian bán hủy khác nhau nên rõ ràng rằng là sự thoái hóa protein không thể là ngẫu nhiên mà thay vào đó nó bị ảnh hưởng bởi một số khía cạnh cấu trúc của protein mà đóng vai trò như là một tín hiệu thoái hóa, điều này được nhận ra và được liên kết bởi một E3. Thời gian bán hủy của một protein cũng bị ảnh hường bởi gốc của đầu tận amino (đầu tận N), vì thế được gọi là quy luật đầu tận N, và thay đổi từ nhiều phút đến nhiều giờ. Các amino acids có đầu N bị mất tính ổn định bao gồm arginine và các amino acids được chỉnh sửa sau dịch mã như alanine được acetyl hóa. Ngược lại, serine là một amino acid có đầu N ổn định. Ngoài ra, các proteins giàu các trình tự chứa proline, glutamate, serine và threonine (được gọi là các trình tự PEST được tạo thành tử các viết tắt một chữ cái của các amino acids này) thì được ubiquitin hóa và thoái hóa một cách nhanh chóng và vì thế có thời gian bán hủy ngắn.
III. Sự tiêu hóa protein trong chế độ ăn
Hầu hết nitrogen trong chế độ ăn được tiêu thụ ở dạng protein, thường có lượng từ 70 đến 100 grams/ngày ở chế độ ăn của người Mỹ (Hình 2). Các proteins nhìn chúng là quá lớn để có thể được hấp thu bởi ruột. (Chú ý: Một ví dụ ngoại lệ là những đứa trẻ mới sinh có thể hấp thu các kháng thể của mẹ trong sữa mẹ). Vì thế, các proteins phải được thủy phân để tạo thành các di- và tripeptides cũng như là các amino acids riêng lẻ, là các thành phần mà có thể được hấp thu. Các enzymes thủy phân protein chịu trách nhiệm cho sự thoái hóa các proteins thì được tạo thành bởi 3 cơ quan khác nhau: dạ dày, tuyến tụy và ruột non (Hình 4).
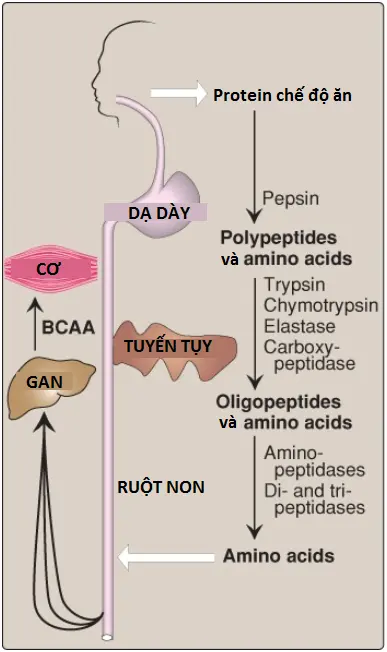
A. Sự tiêu hóa bởi dịch tiết của dạ dày
Sự tiêu hóa của các proteins bắt đầu ở trong dạ dày, nơi mà bài tiết ra dịch dạ dày, một dung dịch duy nhất chứa hydrochloric acid (HCl) (axit clohydric) và tiền enzyme pepsinogen.
1. Hydrochloric acid: HCl dạ dày thì quá loãng (pH từ 2 đến 3) để thủy phân các proteins. Acid, được tiết bởi các tế bào thành (parietal cells) của dạ dày thay vào đó thực hiện sẽ chức năng là giết chết một số vi khuẩn và làm biến tính các proteins, bằng cách đó khiến cho chúng dễ dàng hơn cho sự thủy phân kế tiếp bởi các proteases.
2. Pepsin: Endopeptidase ổn định với acid được bài tiết bởi các tế bào chính (chief cells) của dạ dày dưới dạng một zymogen (hay tiền enzyme) bất hoạt, là pepsinogen. (Chú ý: Nhìn chung, các zymogens chứa thêm các amino acids trong các trình tự của chúng mà ngăn cản chúng không được hoạt hóa về mặt xúc tác. Sự loại bỏ các amino acids này cho phép sự cuộn gập thích hợp cần cho một enzyme hoạt động). Trong sự có mặt của HCl, pepsinogen trải qua một sự thay đổi cấu hình mà cho phép nó phân tách chính nó (sự tự xúc tác) thành dạng hoạt hóa, là pepsin, là thành phần giải phóng các polypeptides và một ít amino acids tự do từ các proteins chế độ ăn.
B. Sự tiêu hóa bởi các enzyme của tụy
Khi đi vào trong ruột non, các polypeptides được tạo ra trong dạ dày bởi hoạt động của pepsin được phân tách nhiều hơn nữa thành các oligopeptides và các amino acids bởi một nhóm các proteases tụy mà bao gồm cả endopeptidases (mà phân tách ở bên trong chuỗi) và exopeptidases (mà phân tách ở một đầu chuỗi). (Chú ý: Bicarbonate [HCO3–], được bài tiết bởi tuyến tụy trong đáp ứng với hormone ruột secretin, làm tăng pH ruột).
1. Tính đặc hiệu: Mỗi trong số các enzyme này có một tính đặc hiệu khác nhau đối với các nhóm R của amino acid bên cạnh liên kết peptide yếu (Hình 5). Ví dụ, trypsin chỉ phân tách khi nhóm carbonyl của liên kết peptide được đóng góp bởi arginine hoặc lysine. Các enzymes này, như pepsin mô tả ở trên, được tổng hợp và bài tiết dưới dạng các zymogens bất hoạt.
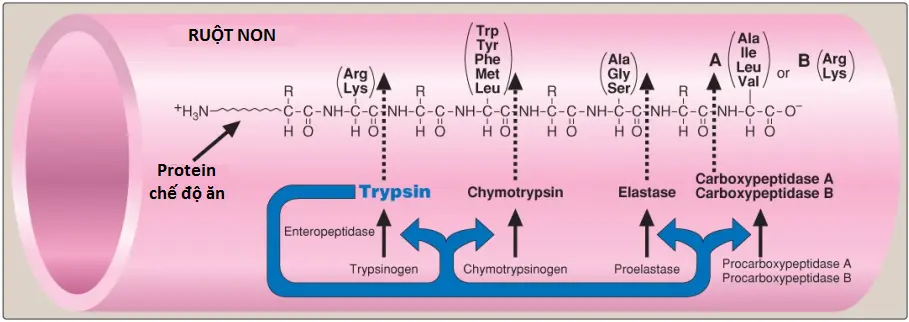
2. Sự giải phóng zymogen: Sự giải phóng và hoạt hóa của các zymogens tụy được điều hòa bởi sự bài tiết của cholecystokinin, một polypeptide hormone của ruột non.
3. Sự hoạt hóa zymogen: Enteropeptidase (còn được gọi là enterokinase), một serine protease được tổng hợp bởi và xuất hiện trên mặt lòng (mặt đỉnh) của các tế bào niêm mạc ruột của bờ bàn chải, chuyển zymogen tụy trypsinogen thành trypsin bởi sự loại bỏ hexapeptide khỏi đầu tận N của trypsinogen. Trypsin tiếp theo chuyển các phân tử trypsinogen khác thành trypsin bằng cách phân tách một số lượng giới hạn các liên kết peptide đặc hiệu trong zymogen. Vì thế, enteropeptidase giải phóng một mô hình hoạt động phân giải protein bởi vì trypsin là yếu tố hoạt hóa chung của tất cả các zymogens tuyến tụy (Hình 5).
4. Các bất thường của sự tiêu hóa: Ở những người mà có sự thiếu hụt trong sự bài tiết của tuyến tụy (ví dụ, do viêm tụy mạn, bệnh xơ nang hoặc phẫu thuật cắt bỏ tụy), thì sự tiêu hóa và hấp thu chất béo và protein không được hoàn toàn. Điều này gây ra sự xuất hiện bất thường của các lipids trong phân (một tình trạng được gọi là phân mỡ [steatorrhea]) cũng như là protein không được tiêu hóa.
Bệnh Celiac là một bệnh rối loạn hấp thu do tổn thương qua trung gian miễn dịch đối với ruột non trong đáp ứng với sự tiêu hóa của gluten (hoặc gliadin được tạo ra từ gluten), một protein được tìm thấy trong lúa mì, lúa mạch và lúa mạch đen.
C. Sự tiêu hóa của các oligopeptides bởi các enzymes của ruột non
Mặt lòng của các tế bào niêm mạc ruột chứa aminopeptidase, một exopeptidase mà phân tách lặp đi lặp lại gốc đầu N khỏi các oligopeptides để tạo thành các peptides thậm chí còn nhỏ hơn và các amino acids tự do.
D. Sự hấp thu của ruột với amino acid và peptide nhỏ
Hầu hết các amino acid tự do được hấp thu vào trong các tế bào niêm mạc ruột thông qua sự vận chuyển tích cực thứ phát phụ thuộc natri bởi các proteins vận chuyển chất tan (solute carrier proteins – SLC) của màng đỉnh. Ít nhất 7 hệ thống vận chuyển khác nhau với các tính đặc hiệu amino acid trùng lặp được biết đến. Tuy nhiên, di- và tripeptides được hấp thu bởi một kênh vận chuyển peptide liên kết proton (PepT1). Các peptides sau đó được thủy phân thành các amino acids tự do. Bất kể nguồn gốc của chúng, các amino acid tự do được giải phóng từ các tế bào niêm mạc vào trong hệ thống cửa bởi các kênh vận chuyển không phụ thuộc natri của màng đáy – bên. Vì thế, chỉ các amino acids tự do được tìm thấy trong tĩnh mạch cửa sau một bữa ăn có chứa protein. Các amino acids này được chuyển hóa bởi gan hoặc được giải phóng vào trong tuần hoàn chung. (Chú ý: Các amino acids phân nhánh [branched-chain amino acids – BCAAs] thì không được chuyển hóa bởi gan mà thay vào đó, nó được đưa từ gan đến cơ thông qua máu [Hình 4]).
E. Các bất thường hấp thu
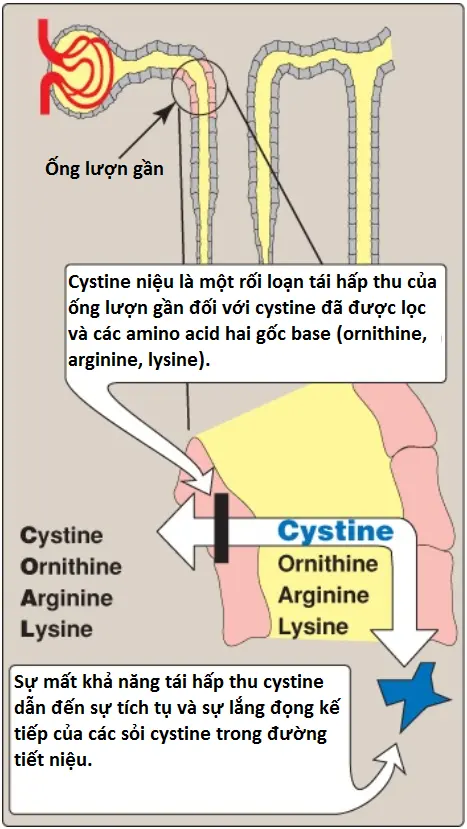
Ruột non và các ống lượn gần của các thận có các hệ thống vận chuyển chung đối với sự hấp thu amino acid. Kết quả, một khiếm khuyết trong bất kỳ một trong số các hệ thống này sẽ gây ra một sự mất khả năng hấp thu các amino acids nhất định vào trong ruột và vào trong các ống thận. Ví dụ, một hệ thống chịu trách nhiệm cho sự hấp thu của cystine và các amino acids hai gốc base ornithine, arginine và lysine (gọi chung là COAL). Trong rối loạn di truyền cystine niệu, hệ thống chất mang này bị khiếm khuyết và tất cả 4 loại amino acids xuất hiện trong nước tiểu (Hình 6). Cystine niệu xảy ra với tần suất là 1 trong 7,000 người, khiến nó trở thành một trong số các bệnh di truyền phổ biến nhất và là sai sót di truyền phổ biến nhất của sự vận chuyển amino acid. Bệnh biểu hiện trên lâm sàng bởi sự lắng đọng của cystine để hình thành nên các sỏi thận (calculi), thành phần mà làm chặn đường tiết niệu. Bổ sung nước đường uống là một phần quan trọng của sự điều trị cho rối loạn này. (Chú ý: Các khiếm khuyết trong sự hấp thu tryptophan bởi một kênh vận chuyển amino acid trung tính có thể gây ra rối loạn Hartnup và các triệu chứng về da và thần kinh giống Pellagra).
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/chuyen-hoa-cholesterol-lipoprotein-va-steroid-phan-5/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!