Các tế bào hồng cầu (red blood cells hay erythrocytes)
Chuyển hóa sắt
Sự hấp thu sắt từ đường tiêu hóa
Sắt được hấp thu từ tất cả các phần của ruột non, hầu như bởi cơ chế sau. Gan bài tiết các lượng apotransferrin trung bình vào trong mật, mà sau đó chảy qua ống mật chủ vào trong tá tràng. Ở đây, apotransferrin liên kết với sắt tự do và cũng với các hợp chất sắt nhất định, như hemoglobin và myoglobin từ thịt, hai trong số các nguồn sắt quan trọng nhất trong chế độ ăn. Sự kết hợp này được gọi là transferrin. Cuối cùng, nó được thu hút bởi và liên kết với các thụ cảm thể của các tế bào biểu mô ruột. Sau đó, bằng phương thức ẩm bào, phân tử transferrin, mang tích trữ sắt của nó, được hấp thu vào trong các tế bào biểu mô và được giải phóng sau đó vào trong các mao mạch máu bên dưới các tế bào này ở dạng transferrin huyết tương (plasma transferrin).
Sự hấp thu sắt từ ruột thì cực kỳ thấp, ở một mức tối đa chỉ một vài milligrams mỗi ngày. Mức độ hấp thu chậm này có nghĩa là ngay cả khi các lượng sắt lớn xuất hiện trong thức ăn thì chỉ các phần nhỏ có thể được hấp thu.
Sự điều hòa tổng lượng sắt trong cơ thể bằng cách kiểm soát mức hấp thu. Khi cơ thể trở nên bão hòa với sắt đến nỗi hầu như tất cả apoferritin trong các vùng dự trữ sắt thì đã kết hợp với sắt thì mức hấp thu sắt thêm từ đường tiêu hóa giảm một cách đáng kể. Ngược lại, khi các sự tích trữ sắt trở nên cạn kiệt, mức hấp thu dường như có thể tăng lên năm hoặc nhiều lần hơn so với bình thường. Vì thế, tổng lượng sắt trong cơ thể được điều hòa chủ yếu bằng cách thay đổi mức hấp thu.
Đời sống của các tế bào hồng cầu là khoảng 120 ngày
Khi RBCs được vận chuyển từ tủy xương vào trong hệ thống tuần hoàn, chúng bình thường tuần hoàn trung bình 120 ngày trước khi bị phá hủy. Mặc dù RBCs trưởng thành không có nhân, ty thể hay lưới nội chất nhưng chúng có các enzymes bào tương mà có khả năng chuyển hóa glucose và hình thành nên các lượng adenosine triphosphate nhỏ. Các enzymes này cũng thực hiện các vai trò sau đây: (1) duy trì tính mềm dẻo của màng tế bào; (2) duy trì sự vận chuyển các ions của màng; (3) giữ sắt của hemoglobin tế bào ở dạng sắt II chứ không phải dạng sắt III; và (4) ngăn cản sự oxy hóa các proteins trong RBCs. Thậm chí là như vậy, các hệ thống chuyển hóa của các RBCs già trở nên dần dần ít hoạt động hơn và các tế bào trở nên ngày càng dễ vỡ, có lẽ bởi vì các quá trình sống của chúng đã kiệt quệ.
Một khi màng RBC trở nên dễ vỡ, tế bào sẽ vỡ ra trong suốt quá trình đi qua một số vị trí hẹp của hệ thống tuần hoàn. Nhiều trong số các RBCs tự phá hủy trong lách, nơi mà chúng nén ép qua tủy đỏ của lách. Ở đó, các khoảng giữa các bè cấu trúc (structural trabeculae) của tủy đỏ, mà qua đó hầu hết các tế bào phải đi qua, chỉ rộng khoảng 3 micrometers, so với đường kính 8 micrometers của RBC. Khi lách bị loại bỏ thì số lượng các RBCs bất thường già tuần hoàn trong máu tăng một cách đáng kể.
Sự phá hủy hemoglobin bởi các đại thực bào. Khi RBCs vỡ và giải phóng hemoglobin của chúng, hemoglobin được thực bào gần như ngay lập tức bởi các đại thực bào trong nhiều phần của cơ thể nhưng đặc biệt là bởi các tế bào Kupffer của gan và các đại thực bào của lách và tủy xương. Trong suốt một vài giờ đến một vài ngày tiếp theo, các đại thực bào giải phóng sắt từ hemoglobin và đưa nó quay trở lại vào trong máu để được mang bởi transferrin hoặc đến tủy xương cho sự sản xuất RBCs mới hoặc đến gan và các mô khác cho sự tích trữ ở dạng ferritin. Phần porphyrin của phân tử hemoglobin được chuyển bởi các đại thực bào qua một loạt các giai đoạn, thành sắc tố mật bilirubin, mà được giải phóng vào trong máu và được loại bỏ sau đó khỏi cơ thể bởi sự bài tiết qua gan vào trong mật. Quá trình này được nói đến trong mối liên hệ với chức năng gan trong một loạt bài viết khác nhé.
Các thiếu máu (anemias)
Thiếu máu có nghĩa là sự thiếu hụt hemoglobin trong máu, điều mà có thể được gây ra bởi có quá ít RBCs hoặc quá ít hemoglobin trong các tế bào. Một số loại thiếu máu và các nguyên nhân sinh lý của nó được mô tả trong các phần sau đây.
Thiếu máu do chảy máu. Sau một sự chảy máu nhanh, cơ thể thay thế phần dịch trong huyết tương trong vòng 1 đến 3 ngày, nhưng đáp ứng này gây ra một nồng độ thấp RBCs. Nếu như một sự chảy máu thứ hai không xảy ra, nồng độ RBC thường sẽ trở về bình thường trong vòng 3 đến 6 tuần.
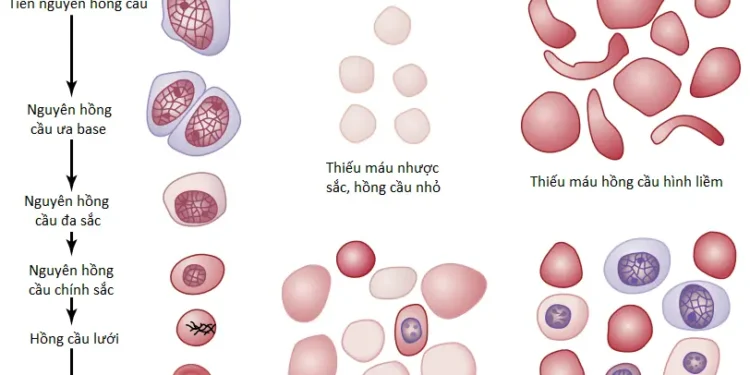
Khi mất máu kéo dài xảy ra, một người thường sẽ không hấp thu đủ sắt từ đường ruột để hình thành nên hemoglobin nhanh như khi bị mất đi. RBCs mà nhỏ hơn nhiều so với bình thường và có quá ít hemoglobin bên trong chúng sau đó được sản xuất, làm xuất hiện thiếu máu nhược sắt hồng cầu nhỏ (microcytic hypochromic anemia), như được thể hiện trong Hình 1.

Thiếu máu bất sản do rối loạn chức năng tủy xương. Bất sản tủy xương nghĩa là thiếu tủy xương đang thực hiện chức năng. Ví dụ, tiếp xúc với phóng xạ liều cao hoặc hóa trị trong điều trị ung thư có thể phá hủy các tế bào gốc của tủy xương, được theo sau một vài tuần bởi thiếu máu. Tương tự, các liều cao của một số hóa chất độc như các thuốc diệt côn trùng hay benzene trong xăng, có thể gây ra cùng tác động. Trong các rối loạn tự miễn, như lupus ban đỏ, hệ thống miễn dịch bắt đầu tấn công các tế bào khỏe mạnh như các tế bào gốc của tủy xương, mà có thể dẫn đến thiếu máu bất sản. Trong khoảng một nửa các trường hợp thiếu máu bất sản thì nguyên nhân là chưa biết, một tình trạng được gọi là thiếu máu bất sản vô căn (idiopathic aplastic anemia).
Những người mắc thiếu máu bất sản nặng thường chết do không được điều trị bởi truyền máu – mà có thể làm tăng tạm thời số lượng RBCs – hoặc bởi cấy ghép tủy xương.
Thiếu máu nguyên hồng cầu lớn (megaloblastic anemia). Dựa trên các sự bàn luận trước đây về vitamin B12, folic acid và yếu tố nội từ niêm mạc dạ dày, chúng ta có thể dễ dàng hiểu được rằng sự mất của bất cứ một trong số các yếu tố này có thể dẫn đến sự sản sinh chậm của các nguyên hồng cầu trong tủy xương. Kết quả, các RBCs phát triển quá lớn, với các hình dạng kì quặc, và được gọi là nguyên hồng cầu lớn (megaloblasts). Vì thế, teo niêm mạc dạ dày, như xảy ra trong thiếu máu ác tính (pernicious anemia), hoặc mất toàn bộ dạ dày sau phẫu thuật cắt bỏ dạ dày (gastrectomy) hoàn toàn có thể dẫn đến thiếu máu nguyên hồng cầu lớn (megaloblastic anemia). Ngoài ra, thiếu máu nguyên hồng cầu lớn thường phát triển ở những bệnh nhân mà có bệnh sprue ruột (intestinal sprue), trong đó, folic acid, vitamin B12 và các hợp chất vitamin B khác được hấp thu kém. Bởi vì các nguyên hồng cầu trong các tình trạng này không thể tăng sinh đủ nhanh để hình thành nên các số lượng RBCs bình thường nên các RBCs mà được hình thành thì hầu như quá cỡ, có các hình dạng dị thường và có các màng dễ vỡ. Các tế bào này vỡ một cách dễ dàng, vì thế, những bệnh nhân này luôn có nhu cầu về một số lượng RBCs đầy đủ.
Thiếu máu huyết tán (hemolytic anemia). Các bất thường khác nhau của RBCs, nhiều trong số đó là mắc phải qua di truyền, khiến cho các tế bào dễ vỡ, vì thế, chúng vỡ một cách dễ dàng khi chúng đi qua các mao mạch, đặc biệt là qua lách. Mặc dù số lượng RBCs được hình thành có thể bình thường hoặc thậm chí nhiều hơn đáng kể so với bình thường trong một số bệnh huyết tán nhưng đời sống của RBC dễ vỡ thì ngắn đến nỗi các tế bào bị phá hủy nhanh hơn việc chúng có thể được hình thành và gây ra thiếu máu nghiêm trọng.
Trong tình trạng tế bào hồng cầu hình cầu di truyền (hereditary spherocytosis), các RBCs thì rất nhỏ và có hình cầu (spherical) chứ không phải là hình đĩa lõm hai mặt. Các tế bào này không thể đứng vững trước các lực đè ép bởi vì chúng không có cấu trúc màng tế bào lỏng lẻo, giống túi của các hình đĩa lõm hai mặt. Khi đi qua tủy lách và một số mạng lưới mạch máu nhỏ khác, chúng dễ dàng bị vỡ thậm chí bởi các lực ép nhỏ.
Trong thiếu máu hồng cầu hình liềm (sickle cell anemia), mà xuất hiện ở 0.3% đến 1.0% những người da đen Tây Phi và những người Mỹ da đen, các tế bào có một loại hemoglobin bất thường được gọi là hemoglobin S, chứa các chuỗi beta bị lỗi trong phân tử hemoglobin, như được giải thích trước đây trong loạt bài viết này. Khi hemoglobin này tiếp xúc với nồng độ oxygen thấp, nó lắng đọng vào trong các tinh thể dài trong RBC. Các tinh thể này làm dài tế bào và làm cho nó có hình dạng lưỡi liềm chứ không phải là một đĩa lõm hai mặt. Hemoglobin lắng đọng cũng sẽ phá hủy màng tế bào, vì thế, các tế bào trở nên rất dễ vỡ, dẫn đến thiếu máu nghiêm trọng. Những bệnh nhân như vậy thường trải qua “vòng luẩn quẩn” của các sự kiện được gọi là cơn bệnh hồng cầu hình liềm (sickle cell disease crisis), trong đó áp lực oxygen thấp trong các mô làm cho hồng cầu có hình liềm, dẫn đến RBCs bị vỡ, tình trạng mà làm giảm hơn nữa trong áp lực oxygen và tạo thêm nhiều hồng cầu hình liềm và sự phá hủy RBC hơn nữa. Một khi quá trình bắt đầu, nó tiến triển nhanh, kết quả là gây ra một sự giảm nghiêm trọng trong RBCs trong vòng một vài giờ và trong một số trường hợp là gây ra tử vong.
Trong tình trạng nguyên hồng cầu thai nhi (erythroblastosis fetalis), RBCs Rh-dương trong thai nhi bị tấn công bởi các kháng thể từ một người mẹ Rh-âm. Các kháng thể này khiến các tế bào Rh-dương dễ vỡ, dẫn đến sự vỡ nhanh và làm cho đứa trẻ được sinh ra với một tình trạng thiếu máu nghiêm trọng. Tình trạng này được nói đến trong một loạt bài viết sau trong mối liên hệ với yếu tố Rh của máu. Sự hình thành cực nhanh của RBCs mới để bù đắp các tế bào đã bị phá hủy trong tình trạng nguyên hồng cầu thai nhi tạo ra một số lượng lớn dạng nguyên hồng cầu (blast) non của RBCs được giải phóng từ tủy xương vào trong máu.
Các tác động của thiếu máu lên chức năng hệ thống tuần hoàn
Độ đặc của máu, mà được nói đến trong loạt bài viết trước, phụ thuộc nhiều vào nồng độ RBCs của máu. Ở những người mà mắc thiếu máu nặng, độ đặc của máu có thể giảm xuống thấp đến 1.5 lần so với nước chứ không phải giá trị bình thường là khoảng 3. Sự thay đổi này làm giảm sức cản đối với dòng máu trong các mạch máu ngoại biên, vì thế, nhiều hơn lượng máu bình thường chảy qua các mô và trở về tim, bằng cách đó, làm tăng đáng kể cung lượng tim. Hơn thế nữa, hạ oxygen mô do giảm sự vận chuyển oxygen bởi máu làm cho các mạch máu ngoại biên giãn, cho phép một sự tăng lên nhiều hơn nữa trong hồi lưu máu trở về tim và làm tăng cung lượng tim đến một mức cao hơn nữa – đôi khi ba đến bốn lần so với bình thường. Vì thế, một trong số các tác động chính của thiếu máu là cung lượng tim tăng lên đáng kể, cũng như là tải bơm máu tăng lên đối với tim.
Cung lượng tim tăng lên ở những người mà mắc thiếu máu làm giảm một phần tác động giảm mang oxygen của thiếu máu bởi vì mặc dù mỗi lượng máu đơn vị mang chỉ các lượng nhỏ oxygen nhưng mức lưu lượng có thể tăng đủ để hầu như các lượng oxygen bình thường thực sự được vận chuyển đến các mô. Tuy nhiên, khi một người mắc thiếu máu bắt đầu gắng sức, tim không có khả năng bơm các lượng máu lớn hơn nhiều lượng máu mà đã bơm. Kết quả, trong suốt quá trình gắng sức, mà làm tăng đáng kể nhu cầu mô đối với oxygen, hạ oxygen mô cực kỳ sẽ xảy ra và suy tim cấp tính có thể diễn ra.
Đa hồng cầu (polycythemia)
Đa hồng cầu thứ phát (secondary polycythemia). Bất cứ khi nào các mô trở nên hạ oxygen do có quá ít oxygen trong không khí thở, như ở các độ cao cao so với mực nước biển, hoặc do suy yếu khả năng mang oxygen đến các mô, như trong suy tim, các cơ quan tạo máu tự động tạo ra các lượng lớn RBCs thêm. Tình trạng này được gọi là đa hồng cầu thứ phát và số lượng RBC thường tăng đến 6 đến 7 triệu/mm3, khoảng 30% trên mức bình thường.
Một loại đa hồng cầu thứ phát thường gặp thứ hai được gọi là đa hồng cầu sinh lý, xảy ra khi những người mà sống ở các độ cao 14,000 đến 17,000 feet so với mực nước biển, nơi mà oxygen khí quyển rất thấp. Số lượng hồng cầu thông thường là 6 đến 7 triệu/mm3, điều mà cho phép những người này thực hiện các mức độ làm việc liên tục khá cao, ngay cả khi là ở khí quyển loãng.
Đa hồng cầu nguyên phát (polycythemia vera hay erythremia). Ngoài đa hồng cầu do sinh lý, một tình trạng bệnh lý được gọi là đa hồng cầu nguyên phát (polycythemia vera) cũng tồn tại, trong đó lượng RBC có thể là 7 đến 8 triệu/mm3 và hematocrit có thể là 60% đến 70% thay vì 40% đến 45%. Đa hồng cầu nguyên phát được gây ra bởi một sự sai sót di truyền trong các tế bào nguyên hồng cầu mà sản xuất ra các tế bào máu. Các tế bào nguyên hồng cầu không còn ngừng sản xuất RBCs khi quá nhiều tế bào hồng cầu đã có mặt nữa. Điều này gây ra sự sản xuất quá mức của RBCs theo cùng cách mà một khối u vú gây ra sự sản xuất quá mức một loại tế bào vú chuyên biệt. Nó cũng thường gây ra sự sản xuất quá mức của các tế bào bạch cầu và tiểu cầu.
Trong đa hồng cầu nguyên phát, không chỉ hematocrit tăng lên mà tổng thể tích máu cũng tăng lên, đôi khi đến gần hai lần so với bình thường. Kết quả, toàn bộ hệ thống mạch máu trở nên ứ máu nặng. Ngoài ra, nhiều mao mạch bị tắc bởi máu đặc; độ đặc của máu trong đa hồng cầu nguyên phát đôi khi tăng từ bình thường là gấp 3 lần so với độ đặc của nước đến gấp 10 lần so với nước.
Tác động của đa hồng cầu lên chức năng của hệ thống tuần hoàn
Do độ đặc của máu tăng lên đáng kể trong đa hồng cầu nên dòng máu đi qua các mạch máu ngoại vi thường rất chậm. Theo như các yếu tố mà điều hòa hồi lưu của máu về tim, như được nói đến trong loạt bài viết trước, tăng độ đặc của máu sẽ làm giảm mức hồi lưu tĩnh mạch về tim. Ngược lại, thể tích máu được tăng lên một cách đáng kể trong đa hồng cầu, điều mà có khuynh hướng làm tăng hồi lưu tĩnh mạch. Thực sự, cung lượng tim trong đa hồng cầu thì không khác nhiều so với bình thường bởi vì hai yếu tố này nhiều hay ít sẽ trung hòa lẫn nhau.
Áp suất động mạch cũng bình thường ở hầu hết những người mắc đa hồng cầu mặc dù khoảng một phần ba trong số họ thì áp suất động mạch được tăng lên. Điều này có nghĩa là các cơ chế điều hòa huyết áp thường có thể làm ngừng khuynh hướng của tăng độ đặc máu trong việc làm tăng sức cản ngoại vi và bằng cách đó, làm tăng áp suất động mạch. Tuy nhiên, vượt qua khỏi các giới hạn nhất định, các sự điều hòa này sẽ suy yếu và tăng huyết áp sẽ phát triển.
Màu sắc của da phụ thuộc lớn vào lượng máu trong đám rối tĩnh mạch dưới nhú của da. Trong đa hồng cầu nguyên phát, lượng máu trong đám rối này thì tăng đáng kể. Hơn thế nữa, bởi vì máu đi một cách chậm chạp qua các mao mạch da trước khi đi vào đám rối mao mạch nên một lượng lớn hơn bình thường hemoglobin bị deoxygen hóa. Màu xanh dương của tất cả các hemoglobin bị deoxygen hóa này “che giấu” đi màu đỏ của hemoglobin được oxygen hóa. Vì thế, một người mắc đa hồng cầu nguyên phát thông thường có một nước da đỏ ửng, pha với một màu hơi xanh (xanh tím).
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!