I. Tổng quan
Cholesterol, rượu steroid chính ở động động vật, thực hiện một số chức năng thiết yếu trong cơ thể. Ví dụ, cholesterol là một thành phần cấu trúc của tất cả các màng tế bào, điều chỉnh độ lỏng của chúng và trong một số mô chuyên biệt, cholesterol là một tiền thân của các acids mật, các hormones steroid và vitamin D. Vì thế, một điều cực kỳ quan trọng là các tế bào của cơ thể phải được đảm bảo một sự cung cấp cholesterol thích hợp. Để đáp ứng nhu cầu này, một loạt các cơ chế vận chuyển, sinh tổng hợp và điều hòa đã phát triển. Gan đóng một vai trò trung tâm trong sự điều hòa cân bằng nội môi cholesterol của cơ thể. Ví dụ, cholesterol đi vào trong gan từ một số nguồn, bao gồm cholesterol trong chế độ ăn cũng như là cholesterol được tổng hợp mới bởi các mô ngoài gan và bởi chính gan. Cholesterol được loại bỏ khỏi gan dưới dạng cholesterol chưa được chỉnh sửa trong mật hoặc nó có thể được chuyển thành các muối mật mà được bài tiết vào trong lòng ruột. Nó cũng có thể đóng vai trò như là một thành phần của lipoproteins huyết tương mà mang các lipids đến các mô ngoại vi. Ở người, cân bằng giữa dòng cholesterol đi vào và dòng cholesterol đi ra thì không hoàn toàn chính xác, điều này gây ra một sự tích tụ dần dần của cholesterol trong các mô, đặc biệt là trong các lớp lót nội mô của các mạch máu. Đây là một sự kiện đe dọa tính mạng tiềm tàng khi sự tích tụ lipid dẫn đến sự hình thành của mảng xơ vữa, gây ra sự hẹp đi của các mạch máu (xơ vữa động mạch) và tăng nguy cơ mắc các bệnh mạch máu tim, não và ngoại vi. Hình 1 tóm tắt các nguồn cholesterol gan chính và các chặng mà cholesterol sẽ rời khỏi gan.

II. Cấu trúc cholesterol
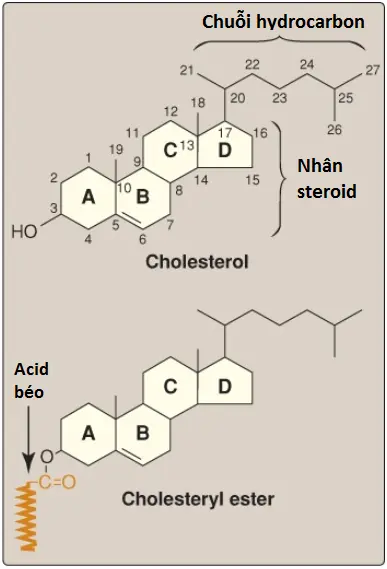
Cholesterol là một hợp chất rất kỵ nước. Nó bao gồm 4 vòng hydrocarbon dính lại với nhau (A-D) được gọi là nhân steroid và nó có một chuỗi hydrocarbon 8-carbon phân nhánh nối với carbon 17 của vòng D. Vòng A có một nhóm hydroxyl ở carbon 3 và vòng B có một liên kết đôi giữa carbon 5 và carbon 6 (Hình 2).
A. Sterols
Các steroids chứa 8 đến 10 nguyên tử carbons trong chuỗi bên ở carbon 17 và một nhóm hydroxyl ở carbon 3 được phân loại là các sterols. Cholesterol là sterol chính trong các mô động vật. Nó có nguồn gốc từ sự tổng hợp mới và sự hấp thu cholesterol trong chế độ ăn. Sự hấp thu cholesterol của ruột được điều hòa bởi “Niemann-Pick C1-like 1 protein” (NPC1L1), là mục tiêu tác dụng của thuốc ezetimibe mà làm giảm sự hấp thu của cholesterol trong chế độ ăn (xem bài viết trước). (Chú ý: Các sterols thực vật [phytosterols], như β-sitosterol, thì được hấp thu kém bởi con người [5% được hấp thu so với 40% của cholesterol]. Sau khi đi vào trong các tế bào niêm mạc ruột, chúng được vận chuyển một cách chủ động quay trở vào trong lòng ruột. Các khiếm khuyết trong các kênh vận chuyển dòng ra [ABCG5/8] gây ra tình trạng được gọi là “sitosterolemia” mà trong đó các sterol thực vật tích tụ trong máu và các mô làm giảm lưu lượng máu và tăng nguy cơ nhồi máu cơ tim, đột quỵ hay đột tử. Bởi vì một ít cholesterol được vận chuyển ngược trở lại nên các sterols thực vật làm giảm sự hấp thu của cholesterol chế độ ăn. Sự tiêu thụ các ester sterol được cung cấp hằng ngày, như trong các đồ phết bánh (spreads), là một trong số các chiến lược ăn uống để làm giảm các mức cholesterol huyết tương [xem các bài viết sau]).
B. Cholesteryl esters
Hầu hết cholesterol huyết tương là ở một dạng được ester hóa (với một acid béo [fatty acid – FA] nối ở carbon 3, như được thể hiện trong Hình 2), điều này làm cho cấu trúc thậm chí còn kỵ nước hơn cholesterol tự do (không được ester hóa). Các cholesteryl esters thì không được tìm thấy trong các màng và bình thường sẽ xuất hiện chỉ với các mức thấp trong hầu hết các tế bào. Bởi vì tính kỵ nước của chúng nên cholesterol và ester của nó phải được vận chuyển trong mối liên hệ với protein như là một thành phần của phần tử lipoprotein hay được hòa tan bởi phospholipids và các muối mật trong mật.
III. Sự tổng hợp cholesterol
Cholesterol được tổng hợp bởi hầu hết tất cả các mô ở người, mặc dù gan, ruột, vỏ thượng thận và các mô sinh dục, bao gồm buồng trứng, tinh hoàn và nhau thai, chiếm các sự đóng góp nhiều nhất trong lượng cholesterol. Như với acid béo, tất cả các nguyên tử carbon trong cholesterol được cung cấp bởi acetyl coenzyme A (CoA) và nicotinamide adenine dinucleotide phosphate (NADPH) cung cấp các đương lượng khử. Con đường tổng hợp là thu năng lượng, được điều khiển bởi sự thủy phân liên kết thioester cao năng lượng của acetyl CoA và liên kết phosphate tận cùng của ATP. Sự tổng hợp cần các enzymes trong bào tương, màng của lưới nội chất trơn (SER) và peroxisomes. Con đường thì đáp ứng với các sự thay đổi trong nồng độ cholesterol và các cơ chế điều hòa tồn tại để cân bằng tốc độ tổng hợp cholesterol với tốc độ bài tiết cholesterol. Một sự mất cân bằng trong sự điều hòa này có thể dẫn đến sự tăng lên trong mức cholesterol huyết tương tuần hoàn, với nguy cơ phát triển bệnh mạch máu.
A. Sự tổng hợp 3-hydroxy-3-methylglutaryl coenzyme A
Hai phản ứng đầu tiên trong con đường sinh tổng hợp cholesterol thì tương tự với trong con đường tạo ra các thể ketone (xem các bài viết trước). Chúng tạo ra sản phẩm là 3-hydroxy-3-methylglutaryl CoA ([HMG CoA], Hình 3). Đầu tiên, hai phân tử acetyl CoA ngưng tụ để hình thành nên acetoacetyl CoA. Tiếp theo, một phân tử acetyl CoA thứ ba được thêm bởi HMG CoA synthase, tạo thành HMG CoA, một hợp chất 6-carbon. (Chú ý: Các tế bào nhu mô gan chứa hai isoenzymes của synthase. Enzyme bào tương tham gia vào trong sự tổng hợp cholesterol, ngược lại, enzyme ty thể thực hiện chức năng trong con đường tổng hợp thể ketone).

B. Sự tổng hợp mevalonate
HMG CoA được khử thành mevalonate bởi HMG CoA reductase. Đây là một bước giới hạn tốc độ và điều hòa quan trọng trong sự tổng hợp cholesterol. Nó diễn ra trong bào tương, sử dụng 2 phân tử NADPH như là các chất khử và giải phóng ra CoA, khiến cho phản ứng không thể đảo ngược (Hình 4). (Chú ý: HMG CoA reductase là một protein màng không thể tách rời (integral protein) của SER, với miền xúc tác của nó nhô vào trong bào tương. Sự điều hòa hoạt động của reductase được bàn luận trong phần D. bên dưới).

C. Sự tổng hợp cholesterol từ mevalonate
Các phản ứng và các enzymes liên quan với sự tổng hợp của cholesterol từ mevalonate được minh họa trong Hình 5. (Chú ý: Số được thể hiện trong các dấu ngoặc vuông bên dưới tương ứng với các phản ứng được đánh số trong hình này).
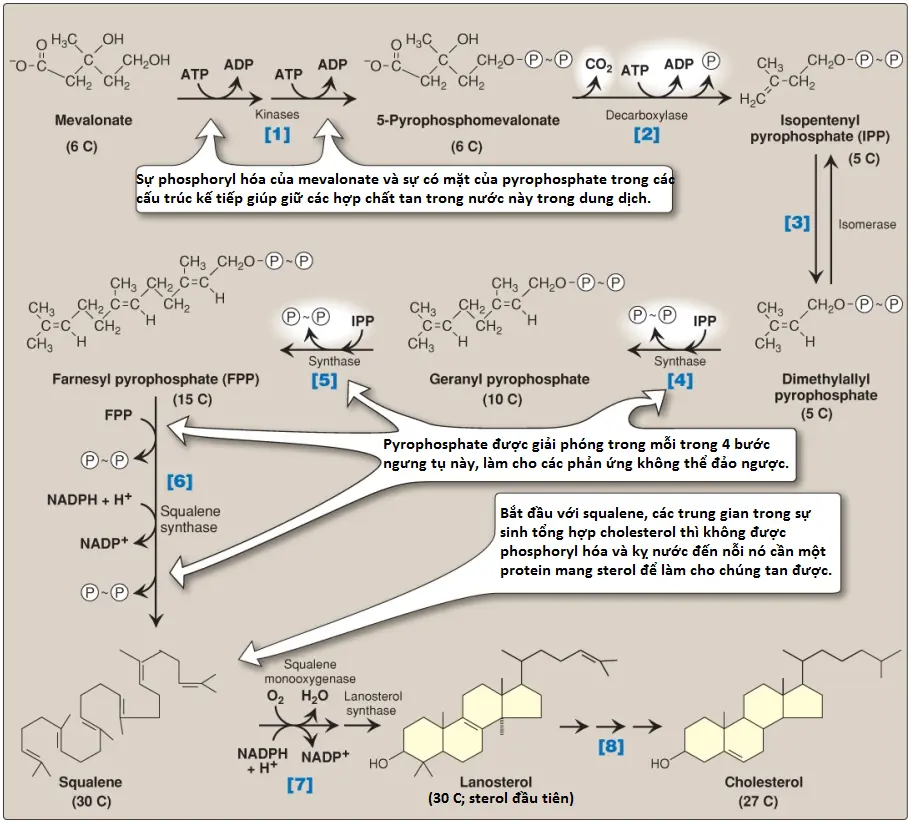
[1] Mevalonate được chuyển thành 5-pyrophosphomevalonate trong 2 bước, mỗi bước trong số đó chuyển một nhóm phosphate từ ATP.
[2] Một đơn vị isoprene 5-carbon, là isopentenyl pyrophosphate (IPP), được hình thành bởi sự decarboxyl hóa của 5-pyrophosphomevalonate. Phản ứng cần ATP. (Chú ý: IPP là tiền thân của một họ các phân tử với các chức năng đa dạng là isoprenoids. Cholesterol là một isoprenoid sterol. Các isoprenoids không phải sterol bao gồm dolichol và ubiquinone [hay, coenzyme Q]).
[3] IPP được isomer hóa thành 3,3-dimethylallyl pyrophosphate (DPP).
[4] IPP và DPP ngưng tụ để hình thành nên geranyl pyrophosphate (GPP) 10-carbon.
[5] Một phân tử IPP thứ hai sau đó ngưng tụ với GPP để hình thành nên farnesyl pyrophosphate (FPP) 15-carbon. (Chú ý: Sự liên kết cộng hóa trị của farnesyl với các proteins, một quá trình được gọi là prenyl hóa, là một cơ chế để nối các proteins [ví dụ như protein ras] với mặt trong các màng bào tương).
[6] Hai phân tử FPP kết hợp lại, giải phóng ra pyrophosphate, và bị khử, hình thành nên hợp chất squalene chứa 30 carbons. (Chú ý: Squalene được hình thành từ 6 đơn vị isoprenoid. Bởi vì 3 ATP bị thủy phân cho mỗi gốc mevalonate được chuyển thành IPP nên tổng cộng có 18 ATP cần để tạo ra polyisoprenoid squalene).
[7] Squalene được chuyển thành sterol lanosterol bởi một trình tự của 2 phản ứng được xúc tác bởi các enzymes liên kết với SER mà sử dụng oxygen phân tử (O2) và NADPH. Sự hydroxyl hóa của squalene chuỗi thẳng khơi mào cho sự đóng vòng của cấu trúc thành lanosterol.
[8] Sự chuyển đổi của lanosterol thành cholesterol là một quá trình nhiều bước liên quan với sự làm ngắn chuỗi bên, sự loại bỏ oxy hóa của các nhóm methyl, sự khử của các liên kết đôi và sự di chuyển của một liên kết đôi. Hội chứng Smith-Lemil-Opitz (SLOS), một rối loạn di truyền lặn trên NST thường của quá trình sinh tổng hợp cholesterol, được gây ra bởi một sự thiếu hụt một phần trong 7-dehydrocholesterol-7-reductase, enzyme mà khử liên kết đôi trong 7-dehydrocholesterol (7-DHC), bằng cách đó, chuyển nó thành cholesterol. SLOS là một trong số các hội chứng rối loạn hình thành thai nhi đa hệ thống liên quan với sự suy giảm tổng hợp cholesterol. (Chú ý: 7-DHC được chuyển thành vitamin D3 trong da [xem các bài viết sau]).
D. Các phản ứng điểm phân nhánh trong sinh tổng hợp cholesterol
Các trung gian của sự tổng hợp cholesterol được sử dụng để sửa đổi thành các phân tử khác. Điểm nhánh đầu tiên bắt đầu với bước 2 ở trên, sự tổng hợp của IPP (5C) (Hình 6). Sự bổ sung tiếp theo của các đơn vị isoprene 5-carbon tạo ra sự tổng hợp lần lượt của geranyl-PP (10C), farnesyl-PP (15C) và geranylgeranyl (20C). Các phân tử này có thể chỉnh sửa các proteins sao cho chúng có thể được nối vào trong các lipids màng. Sự farnesyl hóa của heme tạo ra heme A, một heme đặc hiệu trong cytochrome của chuỗi truyền electron. Sự farnesyl hóa và sự geranylgeranyl hóa của các proteins như các protein ras sinh ung thư (ras oncogene) có thể dẫn đến sự hoạt hóa của các con đường truyền tín hiệu tế bào cho sự tăng sinh tế bào. Sự geranylgeranyl hóa cũng tạo ra dolichol, có vai trò quan trọng trong sự chuyển đường trong suốt quá trình tổng hợp glycoprotein, và ubiquinone, một chất mang electron tan trong lipid trong sự phosphoryl hóa oxy hóa.

Bisphosphonates được sử dụng để ức chế sự tái hấp thu xương trong bệnh loãng xương và bệnh Paget. Sự tạo thành bisphosphonates mới được chứng minh là tiêu diệt các tế bào ung thư bằng cách ức chế sự tổng hợp của farnesyl-PP và geranylgeranyl-PP.
E. Sự điều hòa tổng hợp cholesterol
HMG CoA reductase là điểm kiểm soát chính cho sự sinh tổng hợp cholesterol và là đối tượng của các loại kiểm soát chuyển hóa khác nhau.
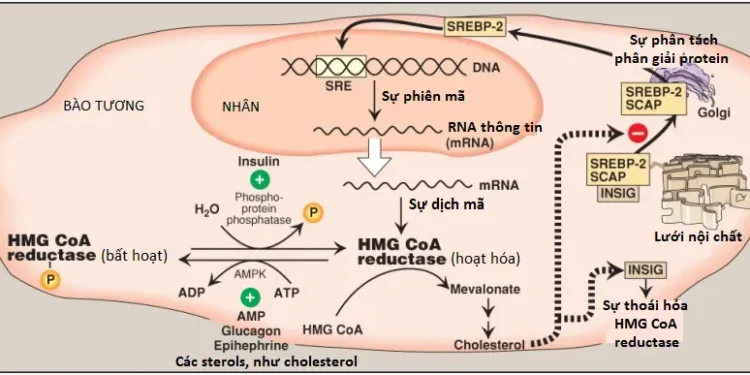
1. Sự điều hòa biểu hiện gene phụ thuộc sterol: Sự biểu hiện của gene HMG CoA reductase được kiểm soát bởi yếu tố tác động trans (trans-acting factor [tạm hiểu yếu tố tác động không nằm trên cùng DNA chứa gene]), là SREBP-2 (sterol regulatory element–binding protein-2 [tạm dịch là protein liên kết thành phần điều hòa sterol 2]), liên kết với DNA ở SER (cis-acting sterol regulatory element [tạm hiểu là thành phần điều hòa sterol tác động cis – tạm hiểu là yếu tố tác động nằm trên cùng DNA chứa gene]) phía đầu (upstream) của gene reductase. SREBP-2 bất hoạt là một protein không thể tách rời của màng SER và liên kết với một protein màng SER thứ hai, là SCAP (SREBP cleavage–activating protein [tạm dịch là protein hoạt hóa phân tách SREBP]). Khi các mức sterol trong SER thấp, phức hợp SREBP-2-SCAP di chuyển từ ER đến bộ máy Golgi. Trong màng bộ máy Golgi, SREBP-2 được tác động một cách tuần tự bởi 2 proteases, điều này có thể tạo ra một thành phần hòa tan mà có thể đi vào trong nhân, liên kết với SRE và thực hiện chức năng như là một yếu tố phiên mã. Điều này làm tăng sự tổng hợp của HMG CoA reductase và vì thế, tăng sự tổng hợp cholesterol (Hình 7). Tuy nhiên, nếu như các mức sterols nhiều, chúng sẽ liên kết với SCAP tại miền nhận cảm sterol của nó và tạo ra sự liên kết của SCAP với các proteins màng ER khác, là INSIGs (insulin-induced gene proteins [tạm hiểu là các proteins gene cảm ứng insulin]). Điều này làm giữ lại phức hợp SCAP-SREBP trong SER, bằng cách đó, ngăn cản sự hoạt hóa của SREBP-2 và dẫn đến sự giảm điều hòa tổng hợp cholesterol. (Chú ý: SREBP-1c làm tăng điều hòa sự biểu hiện của các enzymes liên quan đến sự tổng hợp acid béo trong đáp ứng với insulin).
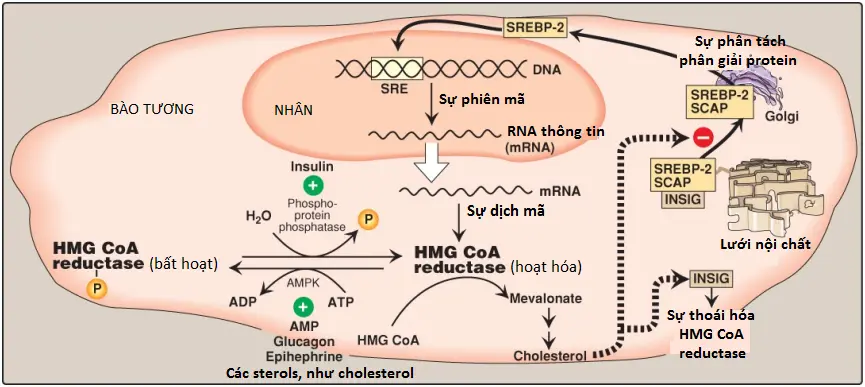
2. Sự thoái hóa của enzyme được tăng cường bởi sterol: Chính reductase là một protein không thể tách rời màng SER nhận cảm sterol. Khi các mức sterols trong SER cao thì enzyme liên kết với các proteins INSIG (xem Hình 7). Sự liên kết dẫn đến sự vận chuyển của bào tương, sự ubiquitin hóa và sự thoái hóa của proteasome của reductase (xem các bài viết sau).
3. Sự phosphoryl hóa/dephosphoryl hóa không phụ thuộc sterol: Hoạt động của HMG CoA reductase được kiểm soát về mặt cộng hóa trị thông qua các hoạt động của protein kinase hoạt hóa bởi adenosine monophosphate (AMP) (AMPK) và một phosphoprotein phosphatase (xem Hình 7). Dạng phosphoryl hóa của enzyme thì bất hoạt, ngược lại, dạng dephosphoryl hóa thì hoạt hóa. (Chú ý: Bởi vì AMPK được hoạt hóa bởi AMP nên sự tổng hợp cholesterol, giống như sự tổng hợp acid béo, bị giảm khi sự có mặt sẵn của ATP giảm).
4. Sự điều hòa hormone: Hoạt động của HMG CoA reductase được kiểm soát về mặt hormone. Một sự tăng lên trong insulin tạo điều kiện cho sự dephosphoryl hóa (sự hoạt hóa) của reductase, ngược lại, một sự tăng lên trong glucagon, epinephrine và các mức cholesterol thì sẽ có tác động trái ngược (xem Hình 7).
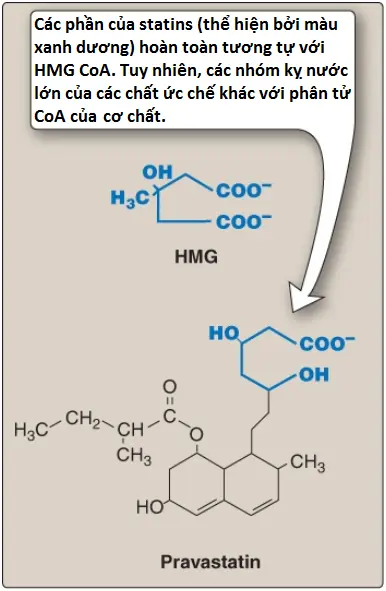
5. Sự ức chế của thuốc: Các thuốc statin (atorvastatin, fluvastatin, lovastatin, pravastatin, rosuvastatin và simvastatin) là các tương tự về mặt cấu trúc của HMG CoA và là (hoặc được chuyển hóa thành) các chất ức chế tranh chấp có thể đảo ngược của HMG reductase (Hình 8). Chúng được sử dụng để làm giảm các mức cholesterol huyết tương ở những bệnh nhân mà bị tăng cholesterol máu. Các tác dụng phụ dễ nhận thấy nhất của các statins bao gồm đau cơ, mỏi cơ, yếu cơ và tiêu cơ vân. Các tác động này có thể là do sự ức chế của quá trình tổng hợp heme A và ubiquinone, cả hai đều cần cho sự phosphoryl hóa oxy hóa để sinh năng lượng (Hình 6). Các sự đa hình di truyền (genetic polymorphisms) cũng tác động đến sự đáp ứng sinh lý với statins. Ví dụ, polypeptide vận chuyển anion hữu cơ (organic anion transporting polypeptide [OATP1B1], còn được gọi là SLCO1B1) có một sự đa hình ở nucleotide 521 T>C mà được sử dụng như là một dấu ấn sinh học (biomarker) đối với bệnh cơ do simvastatin.
IV. Sự thoái hóa cholesterol
Con người không thể chuyển hóa cấu trúc vòng cholesterol thành carbon dioxide và nước. Thay vào đó, nhân steroid liên quan bị loại bỏ khỏi cơ thể bằng sự chuyển đổi thành các acid mật và các muối mật, một phần trăm nhỏ trong đó được bài tiết trong phân và bằng sự bài tiết cholesterol vào trong mật, thành phần mà vận chuyển nó đến ruột để loại bỏ. (Chú ý: Một ít cholesterol trong ruột được chỉnh sửa bởi các vi khuẩn trước khi loại bỏ. Các hợp chất chủ yếu được tạo thành là các isomers coprostanol và cholestanol, là các dẫn xuất khử của cholesterol. Cùng với cholesterol, các hợp chất này tạo nên thành phần sterols phân trung tính).
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/chuyen-hoa-phospholipid-glycosphingolipid-va-eicosanoid-phan-4/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!