I. Tổng quan
Năng lượng sinh học (bioenergetics) mô tả sự truyền và sử dụng năng lượng trong các hệ thống sinh học, quan tâm đến các trạng thái năng lượng ban đầu và cuối cùng của các thành phần phản ứng. Năng lượng sinh học sử dụng một số ý tưởng cơ bản từ lĩnh vực nhiệt động lực học (thermodynamics), đặc biệt là khái niệm năng lượng tự do (free energy). Bởi vì các sự thay đổi trong năng lượng tự do sẽ cung cấp một sự đo lường về tính khả thi về mặt năng lượng của một phản ứng hóa học nên chúng cho phép dự đoán một quá trình hoặc một phản ứng có thể xảy ra hay không. Nói tóm lại, năng lượng sinh học dự đoán việc liệu một quá trình có thể xảy ra hay không, ngược lại, động học (kinetics) đo lường tốc độ phản ứng.
II. Năng lượng tự do
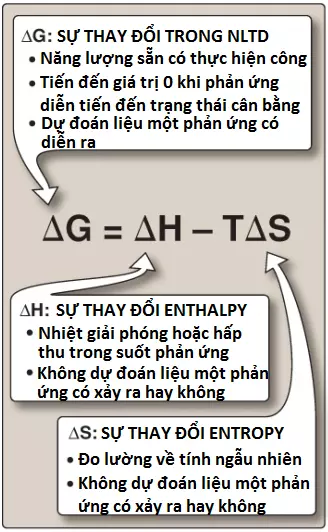
Hướng và mức độ mà một phản ứng hóa học xảy ra được xác định bởi mức độ mà 2 yếu tố thay đổi trong suốt quá trình phản ứng. Các yếu tố này là enthalpy (ΔH, một sự đo lường về sự thay đổi [Δ] trong nhiệt chứa (heat content) của các chất phản ứng và các chất sản phẩm) và entropy (ΔS, một sự đo lường về sự thay đổi trong tính ngẫu nhiên (randomness) hay sự rối loạn (disorder) của các chất phản ứng và các sản phẩm), như được thể hiện trên Hình 1. Bản thân cả hai đại lượng nhiệt động lực học này đều không đủ để xác định liệu một phản ứng hóa học sẽ diễn ra một cách tự phát theo hướng nó được vẽ ra hay không. Tuy nhiên, khi kết hợp về mặt toán học (xem Hình 1), enthalpy và entropy có thể được sử dụng để định nghĩa một đại lượng thứ ba là năng lượng tự do (G), đại lượng này giúp dự đoán hướng mà một phản ứng sẽ diễn ra một cách tự phát.
III. Sự thay đổi năng lượng tự do
Sự thay đổi trong năng lượng tự do được biểu diễn bởi 2 cách, ΔG và ΔG0. Đầu tiên, ΔG (mà không có số “0” trên đầu), đại diện cho sự thay đổi trong năng lượng tự do, vì thế, cho biết hướng của một phản ứng ở bất cứ nồng độ sản phẩm và chất phản ứng nào. Do đó, ΔG là một biến số. Điều này thì tương phản với sự thay đổi năng lượng tự do tiêu chuẩn, (với số “0” ở trên đầu), là sự thay đổi năng lượng khi các chất phản ứng và các chất sản phẩm ở một nồng độ là 1 mol/l. (Chú ý: Nồng độ của proton [H+] được cho là 10-7mol/l [nghĩa là, pH = 7]. Điều này có thể được thể hiện bởi một dấu phết [′], ví dụ, ΔG0′). Mặc dù ΔG0 là một hằng số biểu diễn cho các sự thay đổi năng lượng ở các nồng độ phi sinh lý này của các chất phản ứng và các chất sản phẩm nhưng dù sao đi nữa nó cũng hữu ích trong việc so sánh các sự thay đổi năng lượng của các phản ứng khác nhau. Hơn thế nữa, ΔG0 có thể được xác định dễ dàng từ sự đo hằng số cân bằng.
A. ΔG và hướng phản ứng
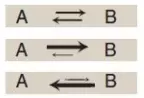
Dấu của ΔG có thể được sử dụng để dự đoán hướng của một phản ứng ở áp suất và nhiệt độ hằng định. Xem xét phản ứng:
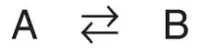
Nếu như ΔG âm thì phản ứng được xem là tỏa năng lượng (exergonic) với một sự mất năng lượng toàn phần. Trong trường hợp này, phản ứng diễn ra một cách tự phát như được vẽ ra, với A được chuyển thành B (Hình 2A). Nếu như ΔG là dương, phản ứng là thu năng lượng (endergonic) với một sự thu năng lượng toàn phần. Năng lượng phải được thêm vào hệ thống để phản ứng từ B đến A có thể xảy ra (Hình 2B). Trong các trường hợp mà ΔG = 0 thì phản ứng đang trong trạng thái cân bằng. Chú ý rằng khi một phản ứng đang diễn ra một cách tự phát (ΔG âm) thì phản ứng sẽ tiếp tục cho đến khi ΔG đạt đến 0 và cân bằng được thiết lập.
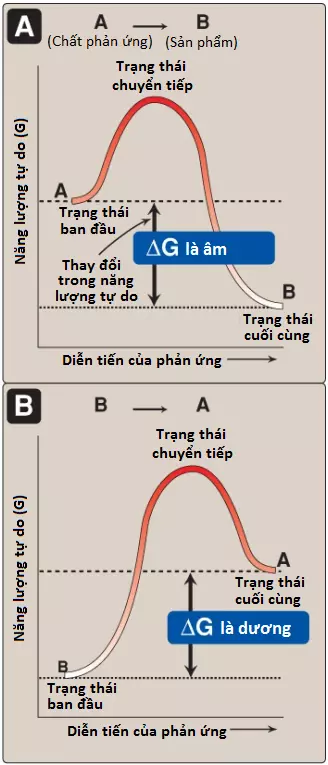
B. ΔG của các phản ứng thuận và nghịch
Năng lượng tự do của phản ứng thuận (A → B) thì bằng về độ lớn nhưng ngược dấu với phản ứng nghịch (B → A). Ví dụ, nếu như ΔG của phản ứng thuận là -5 kcal/mol thì sau đó ΔG của phản ứng nghịch là +5 kcal/mol. (Chú ý: ΔG cũng có thể được biểu diễn ở đơn vị kilojoules mỗi mole hay kJ/mol [1 kcal/mol = 4.2 kJ]).
C. ΔG và các nồng độ của chất phản ứng và sản phẩm
ΔG của phản ứng A → B phụ thuộc vào các nồng độ của chất phản ứng và của sản phẩm. Ở nhiệt độ và áp suất cố định, mối liên hệ sau đây có thể được đưa ra:
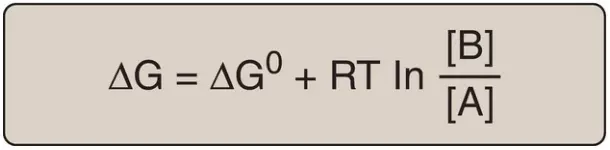
Trong đó:
- ΔG0 là sự thay đổi năng lượng tự do tiêu chuẩn (xem phần D bên dưới)
- R là hằng số khí (1.987 cal/mol K)
- T là nhiệt độ tuyệt đối (K)
- [A] và [B] là các nồng độ thực sự của chất phản ứng và sản phẩm
- ln biểu diễn cho logarithm tự nhiên
Một phản ứng với một ΔG0 dương có thể diễn tiến theo hướng thuận nếu như tỷ lệ của các sản phẩm so với các chất phản ứng ([B]/[A]) là đủ nhỏ (nghĩa là, tỷ lệ của các chất phản ứng so với các sản phẩm là lớn) để làm cho ΔG âm. Ví dụ, xem xét phản ứng sau:
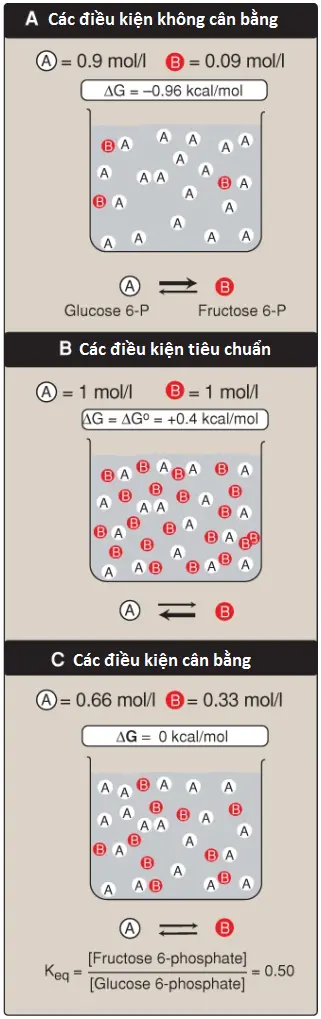
Hình 3A cho thấy các điều kiện phản ứng mà trong đó nồng độ của chất phản ứng, glucose 6-phosphate thì cao so với nồng độ sản phẩm, fructose 6-phosphate. Điều này có nghĩa là tỷ lệ của sản phẩm so với chất phản ứng là nhỏ và RT ln([fructose 6-phosphate]/[glucose 6-phosphate]) thì lớn và âm, làm cho ΔG có giá trị âm mặc dù ΔG0 là dương. Vì thế, phản ứng có thể diễn tiến theo hướng thuận.
D. Sự thay đổi năng lượng tự do tiêu chuẩn
Sự thay đổi năng lượng tự do tiêu chuẩn, ΔG0, thì bằng với sự thay đổi năng lượng tự do, ΔG, dưới các điều kiện tiêu chuẩn khi các chất phản ứng và các chất sản phẩm ở các nồng độ 1 mol/l (Hình 3B). Dưới các điều kiện này, logarithm tự nhiên của tỷ lệ các chất sản phẩm so với các chất phản ứng là 0 (ln1 = 0) và vì thế, phương trình đã được trình bày ở trên sẽ trở thành:
ΔG = ΔG0 + 0
1. ΔG0 và hướng phản ứng: Dưới các điều kiện tiêu chuẩn, ΔG0 có thể được sử dụng để dự đoán hướng của một phản ứng diễn ra bởi vì dưới các điều kiện này, ΔG0 thì bằng với ΔG. Tuy nhiên, ΔG0 không thể dự đoán hướng của một phản ứng dưới các điều kiện sinh lý bởi vì nó hoàn toàn bao gồm các hằng số (R, T và Keq [xem phần 2 bên dưới]) và vì thế, nó không bị thay đổi bởi các sự thay đổi trong các nồng độ sản phẩm hay chất phản ứng.
2. Mối liên hệ giữa ΔG0 và Keq: Trong một phản ứng A ⇄ B, một điểm cân bằng được đạt đến mà không có sự thay đổi hóa học toàn phần xảy ra, Trong trạng thái này, tỷ lệ của [B] so với [A] là hằng số, bất kể các nồng độ thực sự của hai hợp chất là gì:
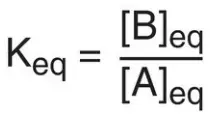
trong đó Keq là hằng số cân bằng, và [A]eq và [B]eq là các nồng độ của A và B ở trạng thái cân bằng. Nếu như phản ứng A ⇄ B được cho phép đạt đến trạng thái cân bằng ở nhiệt độ và áp suất hằng định thì sau đó, ở trạng thái cân bằng, ΔG tổng quan sẽ là bằng 0 (Hình 3C). Vì thế,
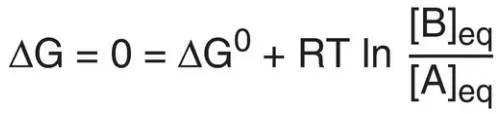
trong đó, các nồng độ thực sự của A và B là các nồng độ ở trạng thái cân bằng của chất phản ứng và sản phẩm ([A]eq và [B]eq) và tỷ lệ của chúng là bằng với Keq. Vì thế,
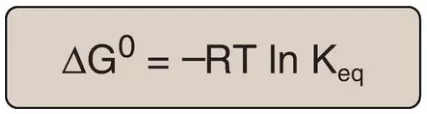
Phương trình này cho phép một số dự đoán đơn giản:
- Nếu Keq = 1 thì ΔG0 = 0
- Nếu Keq > 1 thì ΔG0 < 0
- Nếu Keq < 1 thì ΔG0 > 0
3. Các ΔG0 của các phản ứng liên tục: Các ΔG0 có thể được cộng lại với nhau trong bất kỳ chuỗi các phản ứng liên tục nào giống như với các ΔG. Ví dụ:

4. Các ΔG của một con đường chuyển hóa: Tính chất cộng của ΔG thì rất quan trọng trong các con đường sinh hóa mà qua đó các cơ chất phải đi theo một hướng nhất định (ví dụ, A → B → C → D → …). Khi tổng của các ΔG của các phản ứng riêng rẽ là âm thì con đường chuyển hóa có thể diễn ra như được vẽ, ngay cả khi một số phản ứng riêng rẽ của con đường chuyển hóa có một ΔG dương. Tuy nhiên, các tốc độ thực sự của các phản ứng phụ thuộc vào việc làm thấp các năng lượng hoạt hóa (Ea) bởi các enzyme xúc tác cho các phản ứng.
IV. ATP: một chất mang năng lượng
Các phản ứng với một ΔG dương nhiều thì sẽ có thể được hoạt hóa bằng cách bắt cặp hoạt động thu năng lượng của các ion với một quá trình tự phát thứ hai có ΔG âm nhiều như sự thủy phân tỏa năng lượng của ATP. Hình 4 cho thấy một mô hình cơ học của bắt cặp năng lượng (energy coupling). Ví dụ đơn giản nhất của sự bắt cặp năng lượng trong các phản ứng sinh học xuất hiện khi các phản ứng cần năng lượng và các phản ứng cho năng lượng có cùng một trung gian.
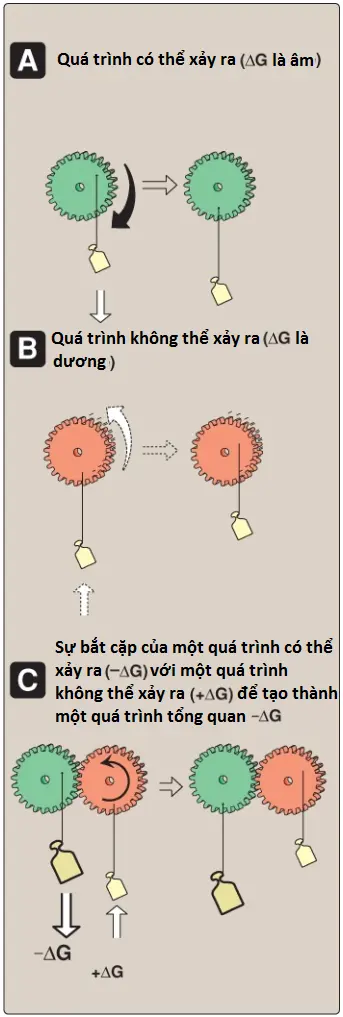
A. Các trung gian chung
2 phản ứng hóa học có chung trung gian khi chúng diễn ra một cách tuần tự, trong đó sản phẩm của phản ứng đầu tiên là một cơ chất cho phản ứng thứ hai. Ví dụ, cho các phản ứng
D là trung gian chung và có thể đóng vai trò như là một chất mang năng lượng hóa học giữa 2 phản ứng. (Chú ý: Trung gian có thể được liên kết với một enzyme). Nhiều phản ứng bắt cặp sử dụng ATP để tạo ra trung gian chung. Các phản ứng này có thể liên quan đến sự chuyển nhóm phosphate từ một ATP đến một phân tử khác. Các phản ứng còn lại liên quan đến sự chuyển nhóm phosphate từ một trung gian giàu năng lượng đến ADP, hình thành nên ATP.
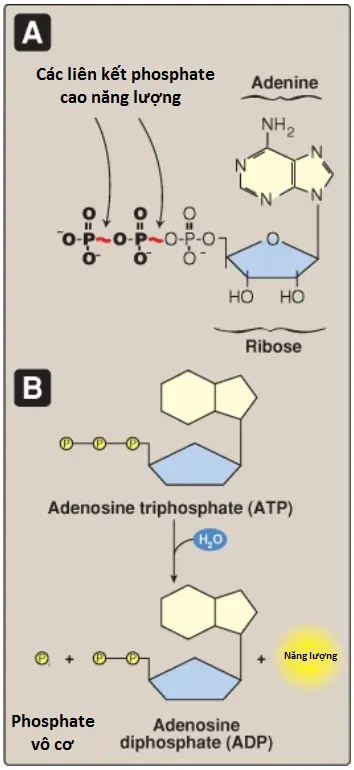
B. Năng lượng được mang bởi ATP
ATP bao gồm một phân tử adenosine mà có 3 nhóm phosphate gắn vào nó (Hình 5). Sự loại bỏ một nhóm phosphate sẽ tạo thành ADP và sự loại bỏ 2 nhóm phosphate sẽ tạo thành adenosine monophosphate (AMP). Đối với ATP, ΔG0 của sự thủy phân là xấp xĩ -7.3 kcal/mol đối với mỗi một trong 2 nhóm phosphate tận cùng. Bởi vì ΔG0 âm lớn này của sự thủy phân nên ATP được gọi là một hợp chất phosphate cao năng lượng. (Chú ý: Các nucleotide adenine được chuyển đổi qua lại [2 ADP ⇄ ATP + AMP] bởi adenylate kinase).
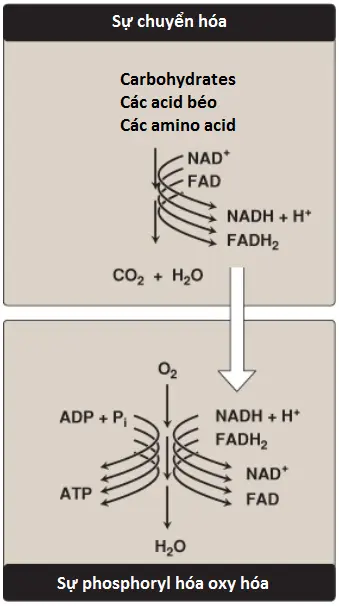
V. Chuỗi truyền electron
Các phân tử giàu năng lượng như glucose được chuyển hóa bởi một chuỗi các phản ứng oxy hóa mà cuối cùng sẽ tạo ra carbon dioxide và nước (H2O) (Hình 6). Các trung gian chuyển hóa của các phản ứng này sẽ đưa các electron đến các coenzyme đặc hiệu là nicotinamide adenine dinucleotide (NAD+) và flavin adenine dinucleotide (FAD), để hình thành nên các dạng khử giàu năng lượng là NADH và flavin adenine dinucleotide (FADH2). Các coenzyme khử này cuối cùng có thể cho một cặp electron đến một tập hợp các chất mang electron, được gọi chung là chuỗi truyền electron (electron transport chain – ETC), được mô tả trong phần này. Khi các electron đường truyền qua ETC, chúng sẽ mất nhiều năng lượng tự do của chúng. Năng lượng này được sử dụng để di chuyển H+ qua màng trong ty thể, tạo ra một gradient H+ mà giúp điều khiển quá trình sản xuất ATP từ ADP và phosphate vô cơ (Pi). Sự bắt cặp của quá trình vận chuyển electron với sự tổng hợp ATP được gọi là sự phosphoryl hóa oxy hóa, đôi khi viết ngắn gọn là OXPHOS. Nó được tiến hành liên tục trong tất cả các mô mà chứa ty thể. Chú ý rằng năng lượng tự do không được giữ lại ở dạng ATP được sử dụng để điều khiển các phản ứng phụ trợ như vận chuyển các ion canxi vào trong các ty thể và tạo nhiệt.
A. Chuỗi truyền electron của ty thể
ETC (trừ cytochrome c) thì nằm ở trong màng trong ty thể và là con đường chung cuối cùng mà các electron có nguồn gốc từ các nguồn nguyên liệu khác nhau của cơ thể đi đến oxygen (O2) và khử nó thành H2O (xem Hình 6).
1. Các màng ty thể: Ty thể có một màng ngoài và một màng trong được phân chia bởi khoang gian màng. Màng ngoài chứa các kênh đặc hiệu được hình thành bởi protein porin, làm cho nó thấm một cách tự do với hầu hết các ion và các phân tử nhỏ. Màng trong là một cấu trúc chuyên biệt mà không thấm với hầu hết các ion nhỏ, bao gồm H+ và các phân tử nhỏ như ATP, ADP, pyruvate và các chất chuyển hóa khác mà quan trọng với chức năng ty thể (Hình 7). Các protein vận chuyển thì cần thiết để di chuyển các ion hay các phân tử qua màng này. Màng trong ty thể thì không thường giàu các protein, hơn một nửa trong số đó là liên quan trực tiếp với sự phosphoryl hóa oxy hóa. Nó cũng chứa các vị trí cuộn được gọi là các mào, điều này làm tăng đáng kể diện tích bề mặt của nó.
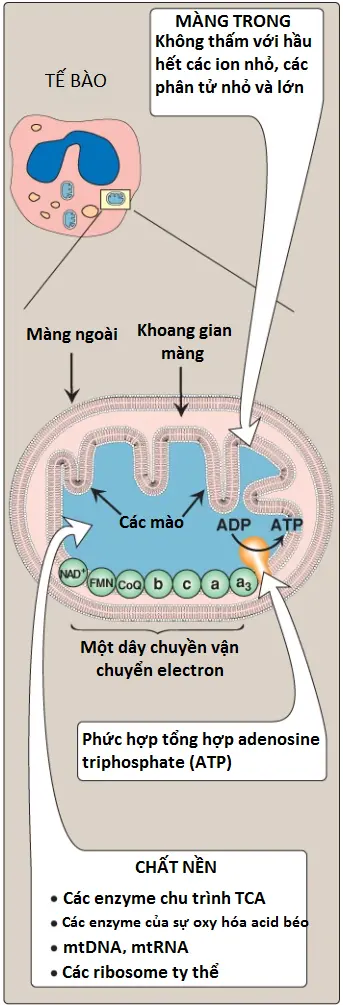
ribonucleic acid; ADP = adenosine diphosphate; TCA = tricarboxylic acid.
2. Chất nền ty thể: Dung dịch dạng gel của phía bên trong ty thể được gọi là chất nền (matrix) và nó cũng giàu các protein. Những protein này bao gồm các enzyme chịu trách nhiệm cho sự oxy hóa của pyruvate, amino acids và acids béo (bằng sự oxy hóa β) cũng như là các enzyme của chu trình tricarboxylic acid (TCA cycle). Sự tổng hợp của glucose, urea và heme xảy ra một phần trong chất nền ty thể. Ngoài ra, chất nền cũng chứa NAD+ và FAD (các dạng oxy hóa của 2 coenzyme làm các chất nhận electron), và ADP và Pi, được sử dụng để sản xuất ATP. (Chú ý: chất nền cũng chứa deoxyribonucleic acid ty thể [mtDNA], ribonucleic acid ty thể [mtRNA] và các ribosomes).
B. Tổ chức
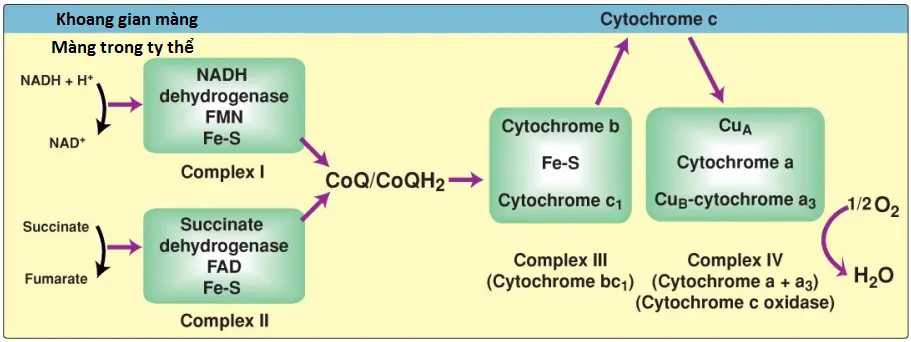
Màng trong ty thể chứa 4 phức hợp protein riêng biệt, được gọi là các Complexs I, II, III và IV mà mỗi Complex chứa một phần của ETC (Hình 8). Các phức hợp này nhận và cho các electron đến các coenzyme Q mang electron tương đối di động (CoQ) và cytochrome c. Mỗi chất mang trong ETC có thể nhận các electron từ một chất cho electron và sau đó có thể cho các electron đến chất nhận tiếp theo trong chuỗi. Các electron cuối cùng sẽ kết hợp với O2 và H+ để hình thành nên H2O. Sự cần đến O2 khiến cho quá trình truyền electron trở thành chuỗi hô hấp (respiratory chain), chiếm phần sử dụng O2 của cơ thể lớn nhất.
C. Các phản ứng
Ngoại trừ CoQ là một quinone tan trong lipid thì tất cả các thành viên của chuỗi truyền electron (ETC) đều là các protein. Các thành phần này có thể đóng vai trò như là các enzyme như trong trường hợp của dehydrogenases chứa flavin, có thể chứa sắt trong phần trung tâm sắt-lưu huỳnh (Fe-S), có thể chứa sắt trong nhóm phụ porphyrin của heme trong cytochrome hoặc có thể chứa đồng (Cu) như của phức hợp cytochrome a + a3.
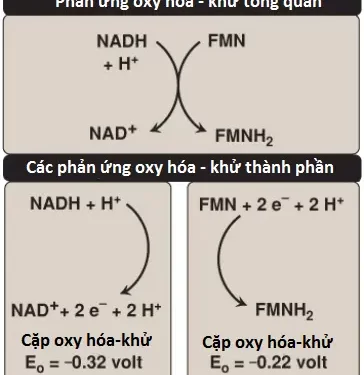
1. Sự hình thành NADH: NAD+ được khử thành NADH bởi dehydrogenases mà giúp loại bỏ 2 nguyên tử hydrogen từ cơ chất của nó. (Chú ý: Đối với các ví dụ của các phản ứng này thì chúng ta có nói đến dehydrogenases của chu trình TCA và nó sẽ được bàn đến sau trong các bài viết sau) Cả hai electron nhưng chỉ một H+ (nghĩa là, một ion hydride [:H–]) được chuyển đến NAD+, hình thành nên NADH cùng với một H+ tự do.
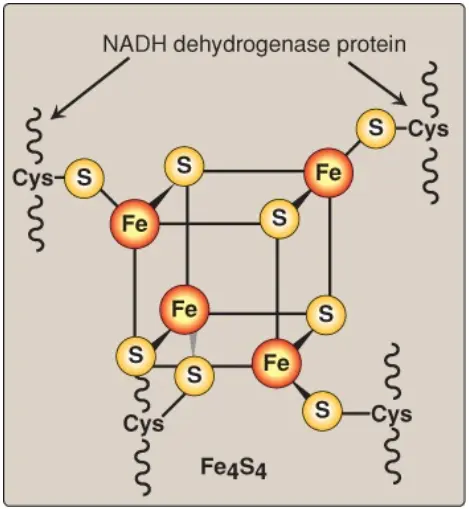
2. NADH dehydrogenase: H+ tự do cùng với ion hydride được mang bởi NADH được chuyển đến NADH dehydrogenase, một phức hợp protein (Complex I) được vùi trong màng trong ty thể. Complex I có một phân tử liên kết chặt là flavin mononucleotide (FMN), một coenzyme liên quan với FAD về mặt cấu trúc mà sẽ nhận 2 nguyên tử hydrogen (2 electron + 2 H+), trở thành FMNH2. NADH dehydrogenase cũng chứa các tiểu đơn vị peptide với các trung tâm Fe-S (Hình 9). Ở Complex I, các electron di chuyển từ NADH đến FMN đến sắt của các trung tâm Fe-S và sau đó đến CoQ. Khi các electron truyền đi, chúng sẽ mất năng lượng. Năng lượng này được sử dụng để bơm 4 H+ qua màng trong ty thể, từ chất nền vào trong khoảng gian màng.
3. Succinate dehydrogenase: Ở Complex II, các electron từ sự oxy hóa succinate thành fumarate được xúc tác bởi succinate dehydrogenase di chuyển từ coenzyme, FADH2, đến một protein Fe-S và sau đó đến CoQ. (Chú ý: Bởi vì không có năng lượng mất trong quá trình này nên không có H+ được bơm ở Complex II).
4. Coenzyme Q: CoQ, còn được biết đến là ubiquinone, là một dẫn xuất quinone với một đuôi isoprenoid kỵ nước dài, được tạo thành từ một trung gian của sự tổng hợp cholesterol (xem các bài viết sau). CoQ là một chất mang electron di động và có thể nhận các electron từ NADH dehydrogenase (Complex I), từ succinate dehydrogenase (Complex II) và từ các dehydrogenase ty thể khác như glycerol 3-phosphate dehydrogenase và acyl CoA dehydrogenase. CoQ chuyển các electron đến Complex III (cytochrome bc1). Vì thế, một chức năng của CoQ là liên kết flavoprotein dehydrogenase với cytochromes.
5. Cytochromes: Các thành viên còn lại của ETC là các protein cytochrome. Mỗi thành viên chứa một nhóm heme là một vòng porphyrin cộng sắt. Không giống như các nhóm heme của hemoglobin, sắt của cytochrome thì được chuyển thuận nghịch từ dạng sắt III (Fe3+) thành dạng sắt II (Fe2+) như là một phần bình thường trong chức năng của nó, là một chất nhận và cho các electron. Các electron được truyền theo chuỗi từ cytochrome bc1 (Complex III) đến cytochrome c và sau đó đến cytochrome a + a3 ([Complex IV], xem Hình 8). Khi các electron được truyền, 4 H+ được bơm qua màng trong ty thể ở Complex III và 2 H+ ở Complex IV. (Chú ý: Cytochrome c thì nằm trong khoang gian màng, liên kết lỏng lẻo với mặt ngoài của màng trong. Giống với CoQ, cytochrome c là một chất mang electron di động).
6. Cytochrome a + a3: Bởi vì phức hợp cytochrome này (Complex IV) là chất mang electron duy nhất mà trong đó sắt của heme có một vị trí phối hợp sẵn mà có thể phản ứng trực tiếp với O2, nên nó cũng được gọi là cytochrome c oxidase. Ở Complex IV, các electron được truyền, O2 và H+ tự do được hợp lại với nhau và O2 được khử thành H2O (xem Hình 8). (Chú ý: 4 electron thì cần để khử một phân tử O2 thành 2 phân tử H2O). Cytochrome c oxidase chứa các nguyên tử Cu mà cần cho phản ứng phức tạp này xảy ra. Các electron di chuyển từ CuA đến cytochrome a đến cytochrome a3 (liên kết với CuB) đến O2.
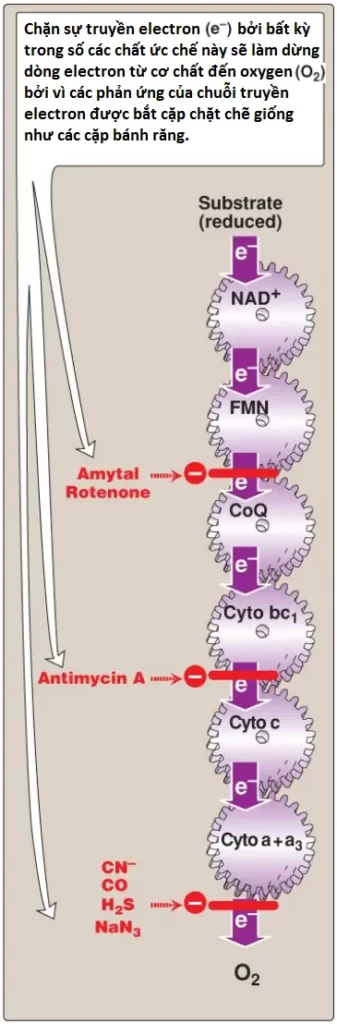
7. Các chất ức chế đặc hiệu vùng: Các chất ức chế của các vùng đặc hiệu trong ETC đã được xác định và minh họa trong Hình 10. Các chất ức chế hô hấp ngăn cản đường đi của các electron bằng cách liên kết với một thành phần của chuỗi, chặn phản ứng oxy hóa – khử. Vì thế, tất cả các chất mang electron trước vị trí chặn thì được khử hoàn toàn, ngược lại những chất mang mà nằm sau vị trí chặn thì bị oxy hóa. (Chú ý: Sự ức chế ETC sẽ ức chế sự tổng hợp ATP bởi vì các quá trình này thì được bắt cặp chặt chẽ với nhau).
Sự thoát các electron từ ETC sẽ tạo ra các gốc oxygen phản ứng (reactive oxygen species – ROS) như superoxide (O2–), hydrogen peroxide (H2O2) và các gốc hydroxyl (OH). Các ROS làm phá hủy DNA và các protein và gây ra sự peroxy hóa lipid. Các enzyme như superoxide dismutase (SOD), catalase và glutathione peroxidase là các sự phòng thủ của tế bào chống lại ROS.
D. Năng lượng tự do giải phóng trong suốt chuỗi truyền electron
Năng lượng tự do được giải phóng khi các electron được truyền qua ETC từ một chất cho electron (các chất khử) đến một chất nhận electron (chất oxy hóa) được sử dụng để bơm H+ ở Complex I, III và IV. (Chú ý: Các electron có thể được truyền dưới dạng các ion hydride đến NAD+; dưới dạng các nguyên tử hydrogen đến FMN, CoQ và FAD; hay dưới dạng các electron đến cytochromes).
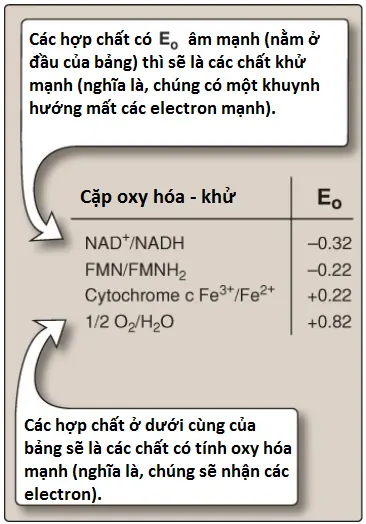
1. Các cặp oxy hóa-khử (redox pairs): Sự oxy hóa (mất các electron) của một chất thì luôn luôn kèm theo bởi sự khử (thu các electron) của một chất thứ hai. Ví dụ, Hình 11 cho thấy sự oxy hóa của NADH thành NAD+ bởi NADH dehydrogenase ở Complex I, kèm theo bởi sự khử của FMN, nhóm phụ, thành FMNH2. Các phản ứng oxy hóa – khử (redox reactions) như vậy có thể được viết lại dưới dạng tổng của hai nửa phản ứng riêng biệt, một là một sự oxy hóa và nửa còn lại là một sự khử (xem Hình 11). NAD+ và NADH hình thành một cặp oxy hóa khử như với FMN và FMNH2. Các cặp oxy hóa – khử khác nhau trong khuynh hướng mất các electron của chúng. Khuynh hướng này là một đặc trưng của một cặp oxy hóa – khử nhất định và có thể được đặc hiệu hóa về lượng bởi một hằng số là E0 (điện thế khử tiêu chuẩn), với đơn vị là volts.

2. Điện thế khử tiêu chuẩn: E0 của các cặp oxy hóa – khử khác nhau có thể được sắp xếp từ E0 âm nhất đến dương nhất. E0 càng âm của một cặp oxy hóa – khử thì khuynh hướng của thành viên khử của cặp oxy hóa – khử đó mất electron càng lớn. E0 càng dương thì khuynh hướng của thành viên oxy hóa của cặp oxy hóa – khử đó nhận electron càng lớn. Vì thế, các electron đi từ cặp oxy hóa – khử có E0 âm hơn đến cặp oxy hóa – khử có E0 dương hơn. Các giá trị E0 đối với một số thành viên của ETC được thể hiện trong Hình 12. (Chú ý: Các thành phần của chuỗi được sắp xếp theo thứ tự của các giá trị E0 dương tăng dần).
3. Mối liên hệ của ΔG0 với ΔE0: ΔG0 thì liên quan trực tiếp với độ lớn của sự thay đổi trong E0:
Trong đó:
- n = số các electron được truyền (1 cho một cytochrome, 2 cho NADH, FADH2 và CoQ)
- F = hằng số Faraday (23.1 kcal/volt mol)
- ΔE0 = E0 của cặp nhận electron trừ đi E0 của cặp cho electron
- ΔG0 = sự thay đổi trong năng lượng tự do tiêu chuẩn
4. ΔG0 của ATP: ΔG0 đối với sự phosphoryl hóa của ADP thành ATP là +7.3 kcal/mol. Sự vận chuyển một cặp electron từ NADH đến O2 qua ETC sẽ giải phóng 52.6 kcal. Vì thế, có nhiều hơn năng lượng đủ để sẵn sàng sản xuất 3 ATP từ 3 ADP và 3 Pi (3 x 7.3 = 21.9 kcal/mol), đôi khi được biểu diễn dưới dạng tỷ số P/O (ATP được sản xuất trên mỗi nguyên tử O bị khử) là 3:1. Lượng năng lượng còn lại được sử dụng cho các phản ứng phụ trợ hay giải phóng dưới dạng nhiệt. (Chú ý: Tỷ số P/O đối với FADH2 là 2:1 bởi vì Complex I bị bỏ qua nhé).
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết trước tại đây: https://docsachxyz.com/chuyen-hoa-nucleotide-phan-2/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!