I. Tổng quan
Proteins là các phân tử phong phú và đa dạng về mặt chức năng nhất trong các hệ thống sống. Trong thực tế, mọi tiến trình sống đều phụ thuộc vào loại đại phân tử này. Ví dụ, các enzymes và các hormone polypeptide điều khiển và điều hòa sự chuyển hóa bên trong cơ thể, ngược lại, các proteins có khả năng co trong cơ sẽ cho phép sự vận động của cơ. Trong xương, protein collagen sẽ giúp hình thành nên một khung cho sự lắng đọng của các tinh thể calcium phosphate. Trong máu, các proteins như hemoglobin và albumin sẽ giúp vận chuyển các phân tử cần thiết cho sự sống, ngược lại, các globulins miễn dịch (immunoglobulins) sẽ chống lại các vi khuẩn và vi rút. Nói ngắn gọn, các proteins cho thấy một sự phong phú về mặt chức năng đáng kinh ngạc mà về bản chất thì các proteins này được cấu tạo từ các chuỗi amino acids. Trong bài viết này thì chúng ta sẽ mô tả các thuộc tính của các amino acids và tầm quan trọng của pH đối với chức năng protein và chức năng cơ thể.
II. Cấu trúc
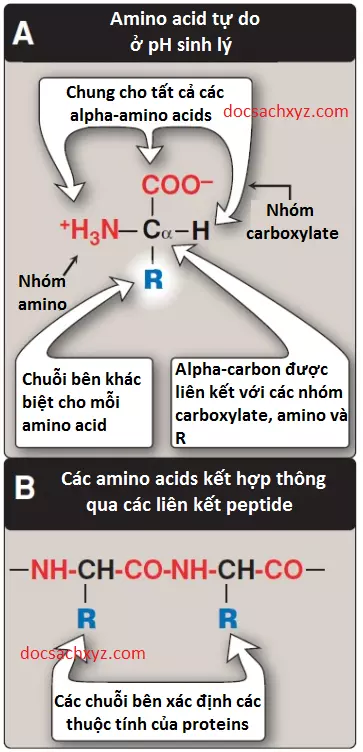
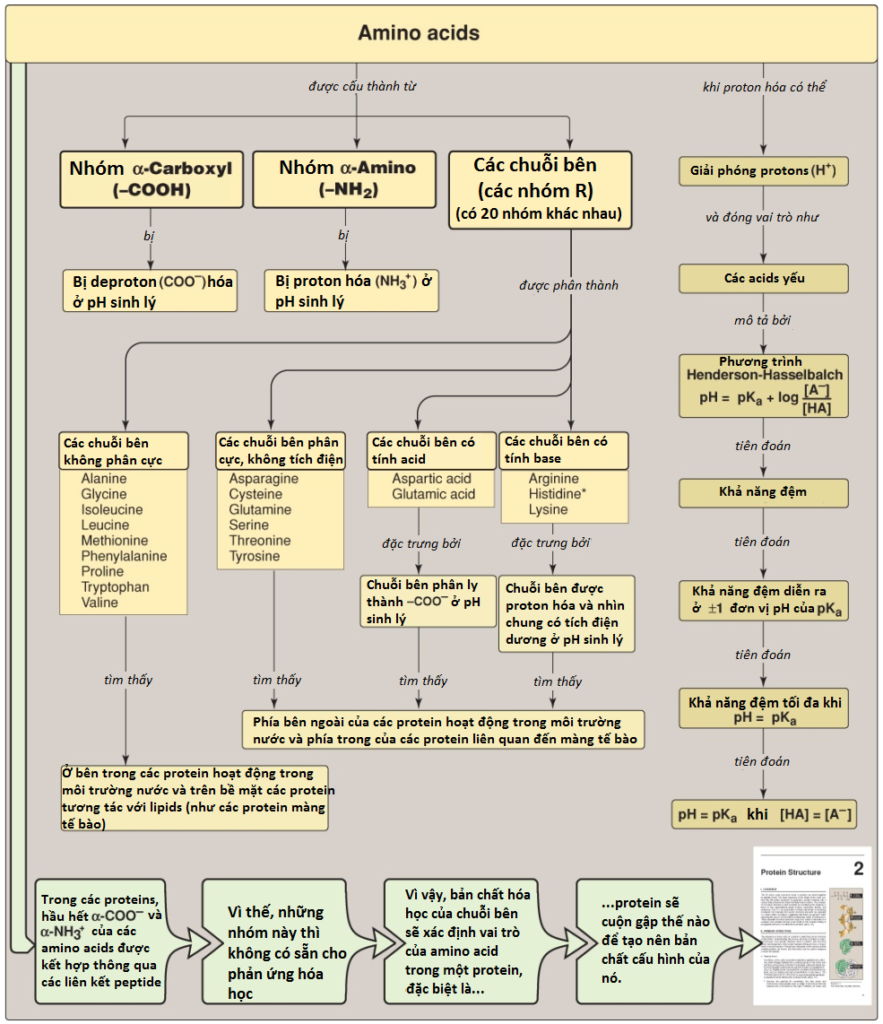
Mặc dù có nhiều hơn 300 amino acids khác nhau được mô tả về đặc điểm nhưng chỉ có 20 amino acids là thường được tìm thấy trong cấu tạo của các proteins ở động vật có vú. 20 amino acids tiêu chuẩn này chỉ bao gồm các amino acids được mã hóa bởi DNA, là vật liệu di truyền trong tế bào. Các amino acids không tiêu chuẩn được tạo ra bởi các chỉnh sửa về mặt hóa học từ các amino acids tiêu chuẩn. Mỗi amino acid có một nhóm carboxyl, một nhóm amino bậc 1 (trừ proline là có nhóm amino bậc hai) và một chuỗi bên đặc trưng hay còn gọi là nhóm R liên kết với nguyên tử alpha-carbon.
Ở pH sinh lý (khoảng 7.4) thì nhóm carboxyl của một amino acid được phân li, hình thành nên các ion carboxylate (-COO–) và nhóm amino được proton hóa (-NH3+) (Hình 1A). Trong các proteins, hầu như tất cả các nhóm carboxyl và amino được kết hợp lại nhờ sự hình thành các liên kết ion peptide. Nhìn chung, các liên kết này thì không tham gia vào trong phản ứng hóa học trừ việc tham gia vào liên kết hydrogen hay liên kết ion (Hình 1B). Các amino acids bên trong các proteins được xem như là các đơn phân có cấu trúc là phần còn lại sau khi liên kết peptide hình thành giữa các amino acids kế tiếp trong một chuỗi peptide. Đặc điểm của các chuỗi bên sẽ quyết định chức năng của một amino acid trong một protein. Vì thế, rõ ràng rằng là sẽ rất phù hợp khi chúng ta phân loại các amino acids theo các thuộc tính chuỗi bên của chúng như việc liệu chuỗi bên không phân cực với một sự phân bố các electrons đồng đều hay không hay phân cực với một sự phân bố các electrons không đồng đều như các acids và các bases hay không (Hình 2 và 3).
A. Các amino acids có chuỗi bên không phân cực
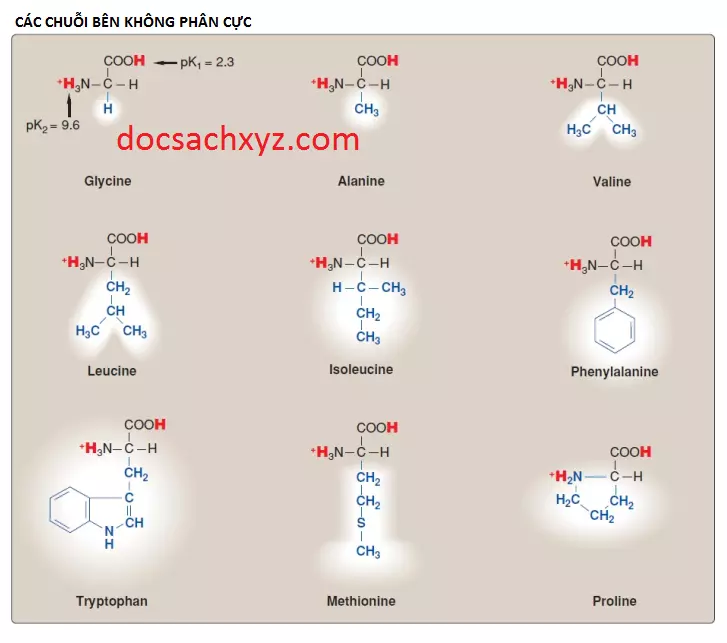
Mỗi amino acids thuộc loại này đều có một chuỗi bên không nhận hay cho protons hay tham gia vào các liên kết hydrogen hay liên kết ion (xem Hình 2). Các chuỗi bên của các amino acids này có thể được xem như là “giống dầu” hay giống lipid, một thuộc tính mà làm thúc đẩy các tương tác kỵ nước.
1. Vị trí trong các proteins: Trong các proteins được tìm thấy trong môi trường phân cực thì các amino acids không phân cực sẽ có khuynh hướng kết tập cùng với nhau ở phía trong của protein (Hình 4). Hiện tượng này được gọi là hiệu ứng kỵ nước và là kết quả của tính kỵ nước của các nhóm R không phân cực, điều này thì gần giống với việc các giọt dầu lơ lửng trong môi trường chứa nước. Bằng cách chiếm lấy phần không gian bên trong của protein đang cuộn gập, những nhóm R không phân cực này sẽ giúp các proteins có được hình dạng ba chiều của chúng.
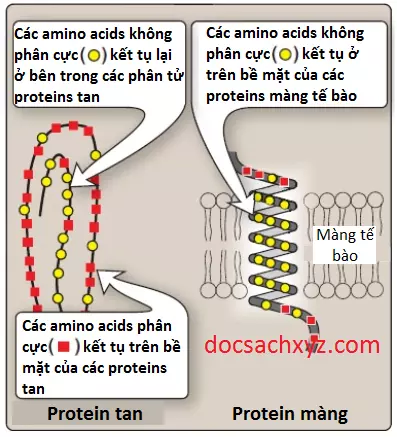
Đối với các proteins trong môi trường kỵ nước như trong lõi kỵ nước của một màng phospholipid thì các nhóm R không phân cực sẽ được tìm thấy ở mặt ngoài của protein, tương tác với môi trường lipid (Hình 4). Tầm quan trọng của các tương tác kỵ nước này trong việc ổn định cấu trúc protein sẽ được bàn luận trong các bài viết sau.
Bệnh thiếu máu hồng cầu hình liềm là một bệnh làm cho các tế bào hồng cầu có hình lưỡi liềm chứ không phải hình đĩa như bình thường. Điều này xảy ra là do sự thay thế glutamate phân cực bằng valine không phân cực ở vị trí thứ 6 trong tiểu đơn vị beta của hemoglobin A.
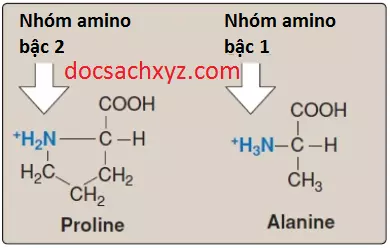
2. Các đặc điểm đặc biệt của proline: Proline khác với các amino acids khác ở việc là chuỗi bên của nó và nguyên nitrogen của nhóm alpha-amino sẽ hình thành nên một cấu trúc vòng gồm 5 nguyên tử vững chắc (Hình 5). Do đó, proline sẽ có một nhóm amino bậc 2 chứ không phải bậc 1 và thường được gọi là một “imino acid”. Cấu hình đặc biệt này của proline sẽ đóng góp vào sự hình thành cấu trúc dạng sợi của collagen nhưng nó sẽ làm gián đoạn cấu trúc xoắn alpha được tìm thấy trong các proteins hình cầu.
B. Các amino acids có chuỗi bên phân cực không tích điện
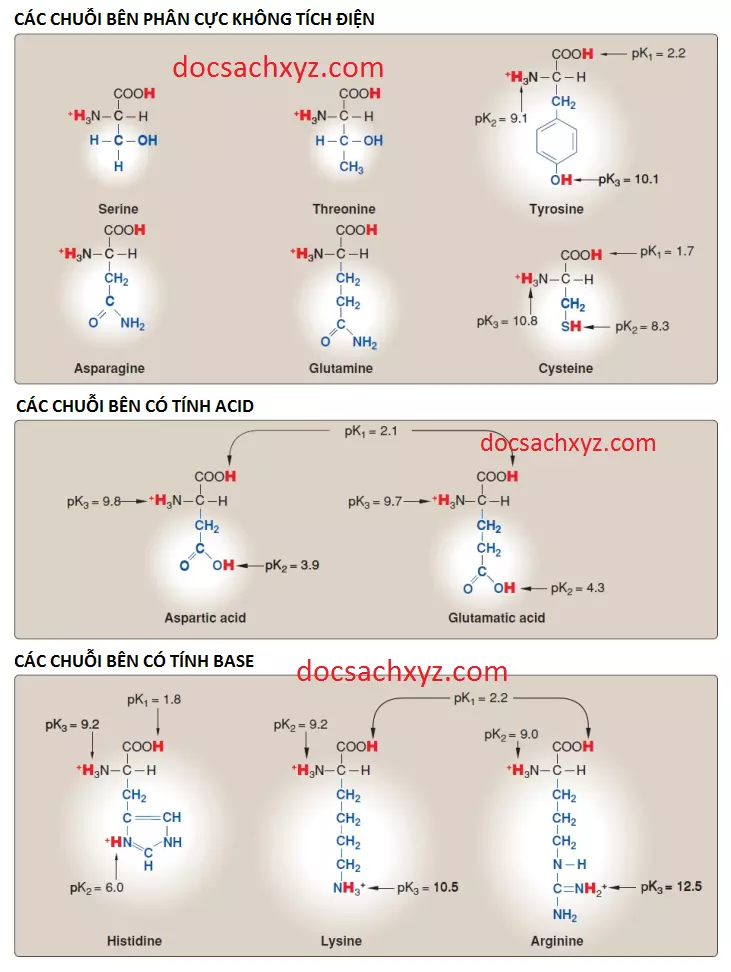
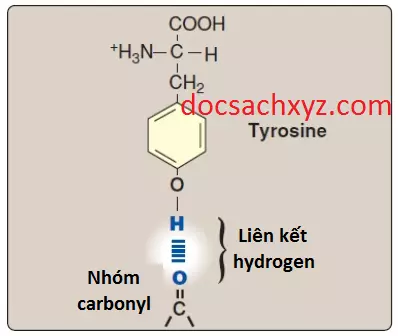
Những amino acids này có điện tích toàn phần là bằng 0 ở pH sinh lý gần 7.4, mặc dù các chuỗi bên của cysteine và tyrosine có thể cho một proton ở pH kiềm (xem Hình 3). Serine, threonine và tyrosine đều chứa một nhóm hydroxyl phân cực có thể tham gia vào trong sự hình thành liên kết hydrogen (Hình 6). Các chuỗi bên của asparagine và glutamine đều chứa một nhóm carbonyl và một nhóm amide, cả hai nhóm này cũng tham gia vào các liên kết hydrogen.
1. Sự hình thành liên kết disulfide: Chuỗi bên của cysteine chứa một nhóm sulfhydryl (thiol) (-SH), là một thành phần quan trọng bên trong vị trí hoạt động của nhiều enzymes. Trong các proteins, nhóm -SH của hai cysteines có thể được oxy hóa để hình thành nên một liên kết ngang cộng hóa trị được gọi là liên kết disulfide (-S-S-). Hai gốc cysteine hình thành nên liên kết disulfide được gọi là cystine.
Nhiều proteins ngoại bào được ổn định bởi các liên kết disulfide. Albumin là một protein đóng vai trò trong việc vận chuyển các loại phân tử khác nhau trong máu chính là một ví dụ. Fibrinogen, một protein trong máu được chuyển thành fibrin để ổn định cục máu đông là một ví dụ khác.
2. Các chuỗi bên đóng vai trò là các vị trí bám cho các hợp chất khác: Nhóm hydroxyl phân cực của serine, threonine và tyrosine có thể đóng vai trò như là một vị trí bám cho các nhóm phosphate. Kinases là các enzymes giúp xúc tác các phản ứng phosphoryl hóa. Phosphatases là các enzymes giúp loại bỏ nhóm phosphate. Các thay đổi trong trạng thái phosphoryl hóa của proteins (liệu có được phosphoryl hóa hay không), đặc biệt là các enzymes, làm thay đổi trạng thái hoạt hóa của chúng; một số enzymes thì hoạt động hơn khi được phosphoryl hóa trong khi một số khác thì sẽ ít hoạt động hơn. Hơn thế nữa, nhóm amide của asparagine cũng như là nhóm hydroxyl của serine và threonine có thể đóng vai trò là các vị trí bám cho các chuỗi oligosaccharide trong các glycoproteins.
C. Các amino acids có chuỗi bên có tính acid
Các amino acids aspartic acid và glutamic acid là các chất cho proton. Ở mức pH sinh lý thì các chuỗi bên của các amino acids này sẽ được ion hóa hoàn toàn và chứa một nhóm carboxylate tích điện âm (-COO-). Dạng ion hóa hoàn toàn của các amino acids này sẽ được gọi là aspartate và glutamate.
D. Các amino acids có chuỗi bên có tính base
Các chuỗi bên của các amino acids có tính base sẽ nhận các protons (xem Hình 3). Ở pH sinh lý, các nhóm R của lysine và arginine sẽ được ion hóa hoàn toàn và tích điện dương. Ngược lại, nhóm R của histidine tự do có tính base yếu và phần lớn không tích điện ở pH sinh lý. Tuy nhiên, khi histidine được tích hợp vào trong một protein thì nhóm R của histidine có thể được tích điện dương (proton hóa) hay trung tính, phụ thuộc vào môi trường ion của protein. Đây là thuộc tính quan trọng của histidine đóng góp vào chức năng đệm mà loại amino acid này thực hiện trong các proteins bao gồm hemoglobin. Histidine là amino acid duy nhất có chuỗi bên có thể bị ion hóa trong khoảng pH sinh lý (7.35 đến 7.45).
Ứng dụng lâm sàng 1.1: Insulin tác động chậm, kéo dài được tạo ra bằng cách thay thế các amino acids
Insulin glargine được phép sử dụng ở Hoa Kỳ vào năm 2000. Nó là một dạng insulin tác động chậm được tạo ra trong phòng thí nghiệm bằng cách thay thế asparagine bình thường ở vị trí thứ 21 trong chuỗi A của insulin bằng glycine và mở rộng đầu carboxy bằng cách thêm 2 gốc arginine. Kết quả của những sự thay đổi này là dạng ít tan trong nước của insulin với điện tích toàn phần là +0.2, gần với mức điện tích 0, làm cho sự hấp thu insulin glargine chậm hơn tại vị trí tiêm. Sự thay thế glycine sẽ làm cản sự deamide hóa (mất nhóm amide) của asparagine ở pH có tính acid trong khoang trung tính dưới da. Sự thêm vào các gốc arginine sẽ làm chuyển điểm đẳng điện từ pH 5.4 đến pH 6.7, làm cho phân tử này tan nhiều hơn ở pH acid và ít tan hơn ở pH trung tính. Vì thế, insulin glargine là một dạng insulin mà tác động chậm, có hoạt động kéo dài hơn và ít cần phải tiêm thường xuyên hơn. Dạng insulin này có thể hữu ích trong điều trị đái tháo đường và giúp bệnh nhân đạt được sự kiểm soát đường huyết tốt hơn.
E. Các viết tắt và các ký hiệu đối với các amino acids thường gặp
Mỗi amino acid sẽ có một cách viết tắt gồm 3 chữ cái và một cách ký hiệu gồm 1 chữ cái (Hình 7). Ký hiệu gồm 1 chữ cái của amino acid được xác định bởi các quy luật sau đây:
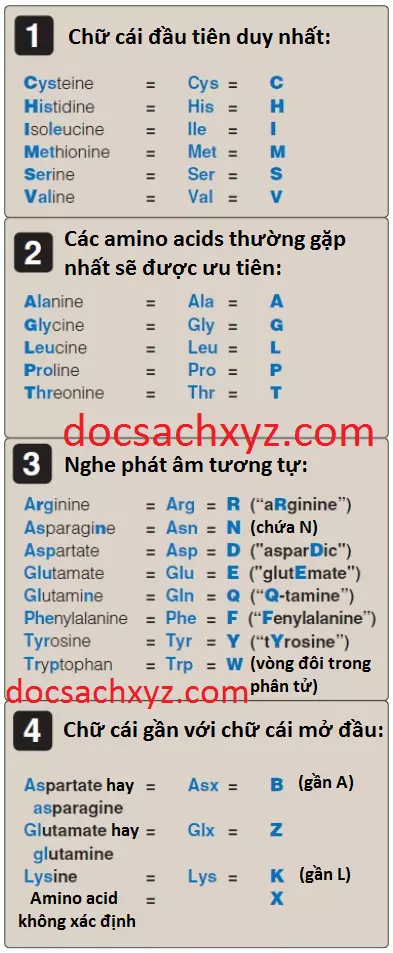
1. Chữ cái đầu tiên duy nhất: Nếu như chỉ có duy nhất một amino acid được bắt đầu với một chữ cái nào đó thì chữ cái đó sẽ được sử dụng làm ký hiệu cho amino acid đó. Ví dụ: V = valine.
2. Các amino acids thường gặp nhất sẽ được ưu tiên: Nếu như có nhiều hơn một amino acid bắt đầu với một chữ cái nào đó thì amino acid thường gặp nhất trong số các amino acids này sẽ được nhận chữ cái đó làm ký hiệu. Ví dụ, glycine thì thường gặp hơn glutamate nên G = glycine.
3. Các tên phát âm tương tự một chữ cái nào đó: Một số ký hiệu một chữ cái nghe phát âm giống như tên amino acid mà nó đại diện. Ví dụ, F = phenylalanine.
4. Chữ cái gần với chữ cái mở đầu: Đối với các amino acids còn lại thì ký hiệu một chữ cái được gán cho chúng sẽ là chữ cái gần với chữ cái mở đầu của amino acid nhất có thể. Ví dụ, K = lysine. Ngoài ra, B được gán cho Asx, biểu thị cho cả aspartic acid hay asparagine; Z được gán cho Glx, biểu thị cho glutamic acid hay glutamine; W được sử dụng cho tryptophan và X được sử dụng để biểu thị cho một amino acid không xác định.
F. Các đồng phân amino acid
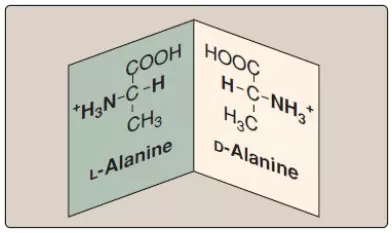
Bởi vì alpha-carbon của một amino acid được gắn với 4 nhóm hóa học khác nhau nên nó sẽ trở thành một nguyên tử carbon bất đối xứng. Glycine là một ngoại lệ bởi vì alpha-carbon của nó có 2 nhóm thế hydrogen. Các amino acids có một carbon bất đối xứng sẽ tồn tại ở 2 dạng đồng phân khác nhau, được gọi là D và L, đây là các đồng phân đối quang, giống như hình ảnh soi gương (Hình 8). (Chú ý: Các đồng phân đối quang có hoạt tính quang học. Nếu như một đồng phân, D hoặc L, làm cho mặt phẳng của ánh sáng phân cực xoay theo chiều kim đồng hồ thì nó được gọi là dạng [+].) Tất cả các amino acids được tìm thấy trong các proteins của động vật có vú là ở cấu hình dạng L. Tuy nhiên, D-amino acids được tìm thấy trong một số kháng sinh và trong các thành tế bào vi khuẩn (Chú ý: Racemases có hoạt tính về mặt enzyme giúp chuyển đổi giữa các đồng phân D- và L- của các amino acids tự do.)
III. Các thuộc tính acid và base của các amino acids
Các amino acids trong một dung dịch nước chứa các nhóm alpha-carboxyl có tính acid yếu và các nhóm alpha-amino có tính base yếu. Ngoài ra, mỗi amino acid có tính acid và có tính base cũng chứa một nhóm có thể bị ion hóa trong chuỗi bên của nó. Vì thế, cả các amino acids tự do và một số amino acids kết hợp bằng các liên kết peptide với nhau có thể đóng vai trò như các hệ đệm. Các acids có thể được định nghĩa là các chất cho proton và các bases là các chất nhận proton. Các acids (hay các bases) được xem là yếu khi sự ion hóa chỉ xảy ra đến một mức độ nhất định.
A. pH
Nồng độ của protons ([H+]) trong dung dịch nước được biểu thị bởi pH:
pH = log 1/[H+] hay -log[H+]
1. Hằng số phân ly: Muối hay các base liên hợp, A–, là dạng ion hóa của một acid yếu. Theo định nghĩa, hằng số phân ly của acid, Ka, là:
Ka = [H+][A–]/[HA]
Ka càng lớn thì acid càng mạnh bởi vì hầu hết HA được phân ly thành H+ và A–. Ngược lại, Ka càng nhỏ thì càng ít acid được phân ly ra và vì thế, acid càng yếu.
2. Phương trình Henderson-Hasselbalch: Bằng cách giải phương trình để tìm [H+] trong phương trình trên, chúng ta sẽ thực hiện logarith cả hai vế của phương trình, nhân cả hai vế phương trình với -1 và sau đó thay pH = -log [H+] và pKa = -log Ka thì chúng ta sẽ thu được phương trình Henderson-Hasselbalch:
pH = pKa + log[A–]/[HA]
Phương trình này cho thấy mối liên hệ về lượng giữa pH của dung dịch và nồng độ của acid yếu (HA) và base liên hợp của nó (A–).
B. Các hệ đệm (buffers)
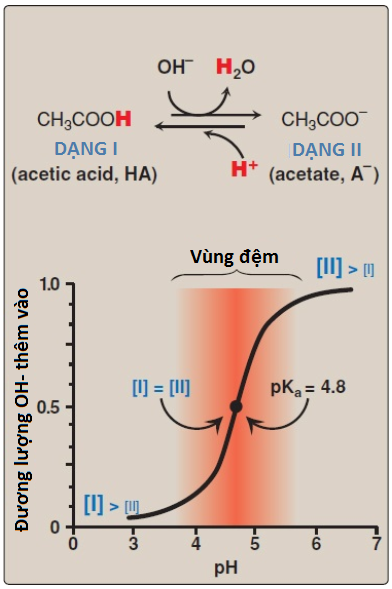
Một hệ đệm là một dung dịch ngăn cản sự thay đổi pH sau khi thêm một acid hoặc một base và có thể được tạo ra bằng cách trộn một acid yếu (HA) với base liên hợp của nó (A–). Nếu như một acid được thêm vào trong một hệ đệm thì A- có thể trung hòa nó và A– được chuyển thành HA trong quá trình này. Nếu như một base được thêm vào thì HA tương tự có thể trung hòa nó, và HA được chuyển thành A– trong quá trình này.
Khả năng của hệ đệm đạt tối đa khi pH bằng với pKa nhưng một cặp acid-base liên hợp vẫn có thể đóng vai trò là một hệ đệm hiệu quả khi pH của dung dịch nằm trong khoảng +- 1 đơn vị pH của pKa. Nếu như lượng HA và A– bằng nhau thì pH sẽ bằng với pKa. Như trong Hình 9, một dung dịch chứa acetic acid (HA = CH3-COOH) và acetate (A– = CH3-COO–) với một pKa là 4.8 sẽ giúp ngăn cản hiệu quả một sự thay đổi trong pH từ 3.8 đến 5.8, với khả năng đệm tối đa ở pH 4.8. Ở giá trị pH thấp hơn pKa thì dạng acid proton hóa (CH3-COOH) là dạng chủ yếu trong dung dịch. Ở pH lớn hơn pKa thì dạng base (CH3-COO–) mới là dạng chủ yếu.
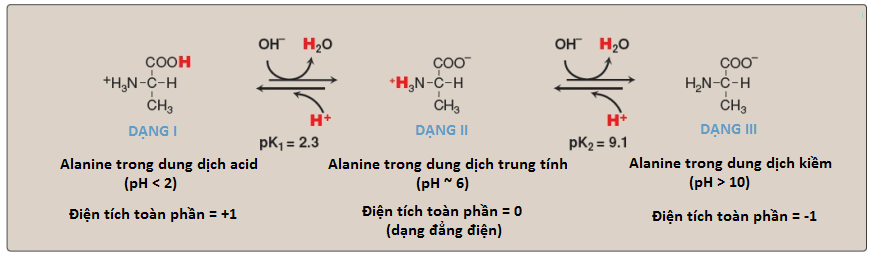
1. Sự phân ly của nhóm carboxyl: Hằng số phân ly của nhóm carboxyl trong một amino acid được gọi là K1 chứ không phải là Ka bởi vì phân tử có chứa một nhóm chuẩn độ thứ hai. Phương trình Henderson-Hasselbalch có thể được sử dụng để phân tích sự phân ly của nhóm carboxyl trong alanine.
K1 = [H+] [II] / [I]
trong đó I là dạng được proton hóa hoàn toàn của alanine và II là dạng đẳng điện của alanine (Hình 10). Phương trình này có thể được sắp xếp lại và được chuyển thành dạng logarith của nó như sau:
pH = pK1 + log [II] / [I]
2. Sự phân ly của nhóm amino: Nhóm chuẩn độ thứ hai của alanine là nhóm amino (-NH3+). Bởi vì đây là một acid yếu hơn nhiều so với nhóm -COOH cho nên nó có hằng số phân ly nhỏ hơn nhiều, K2. (Chú ý: pKa của nó vì thế sẽ lớn hơn nhé). Sự giải phóng của một H+ từ nhóm amino được proton hóa của dạng II sẽ tạo thành dạng deproton hóa hoàn toàn của alanine, dạng III.
3. Các pKs và trình tự phân ly: Trình tự phân li của H+ từ các nhóm carboxyl và amino được tổng hợp trong Hình 10, sử dụng alanine làm ví dụ. Mỗi nhóm chuẩn độ có một pKa bằng với pH mà ở đó đúng một nửa H+ được loại bỏ khỏi nhóm đó. pKa đối với nhóm có tính acid nhất (-COOH) là pK1, ngược lại, pKa đối với nhóm có tính acid nhất tiếp theo (-NH3+) là pK2. (Chú ý: pKa của nhóm alpha-carboxyl của amino acids là khoảng 2, ngược lại pKa của nhóm alpha-amino là khoảng 9).
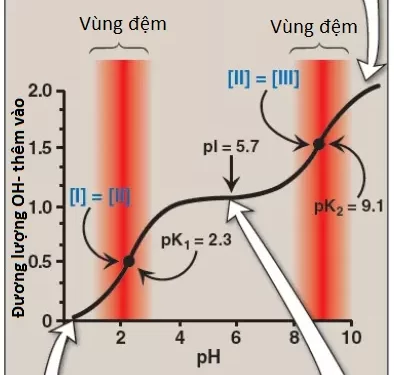
Bằng cách áp dụng phương trình Henderson-Hasselbalch vào mỗi nhóm acid có thể phân li thì chúng ta có thể tính toán được hoàn toàn đường cong chuẩn độ của một acid yếu. Hình 11 cho thấy sự thay đổi của pH xảy ra trong suốt quá trình thêm base vào trong dạng proton hóa hoàn toàn của alanine (I) để tạo ra dạng deproton hóa hoàn toàn (III).
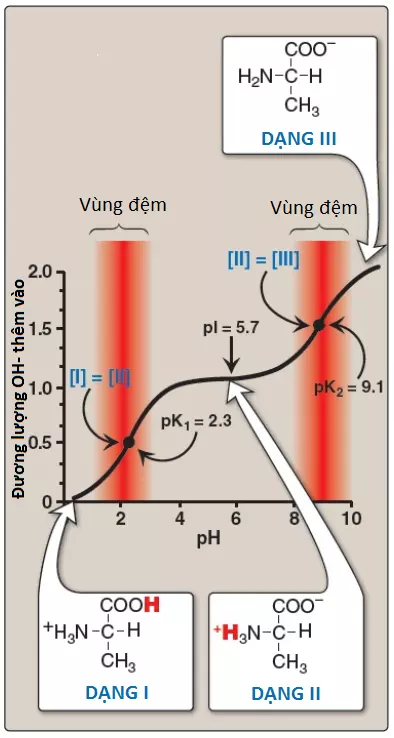
a. Các cặp hệ đệm: -COOH/-COO– có thể đóng vai trò như là một hệ đệm trong vùng pH quanh pK1 và cặp -NH3+/-NH2 có thể đệm trong vùng quanh pK2.
b. Khi pH = pK: Khi pH bằng với pK1 (2.3) thì một lượng bằng nhau giữa dạng I và dạng II của alanine sẽ tồn tại trong dung dịch. Khi pH bằng với pK2 (9.1), các lượng bằng nhau của dạng II và dạng III xuất hiện trong dung dịch.
c. Điểm đẳng điện pI: Ở pH trung tính, alanine tồn tại chủ yếu ở dạng II lưỡng cực trong đó các nhóm amino và carboxyl đều được ion hóa nhưng điện tích toàn phần là 0. Điểm đẳng điện (pI) là pH mà ở đó một amino acid sẽ trung hòa về mặt điện thế, đó là khi tổng các điện tích dương bằng với tổng điện tích âm. Đối với alanine, chỉ có 2 hydrogen có thể phân ly (một từ nhóm alpha-carboxyl và một từ nhóm alpha-amino), thì điểm pI sẽ là trung bình cộng của pK1 và pK2 (pI = [2.3 + 9.1]/2 = 5.7) như trong Hình 11. Vì thế, pI là điểm chính giữa của pK1 (2.3) và pK2 (9.1). pI tương ứng với pH mà ở đó dạng II (với điện tích toàn phần bằng 0) chiếm chủ yếu và có một lượng bằng nhau giữa hai dạng I (điện tích toàn phần là +1) và III (điện tích toàn phần là -1).
Trong phòng thí nghiệm, sự phân tách các protein huyết tương bởi sự tích điện thì thường được thực hiện ở một pH cao hơn pI của các protein chính. Vì thế, ở một pH cao (kiềm) thì điện tích trên các protein là điện tích âm. Trong một điện trường, các protein sẽ di chuyển về phía điện cực dương với một tốc độ được xác định bởi tổng điện tích âm của chúng. Các thay đổi trong cách di chuyển thì sẽ có liên quan đến các bệnh lý nhất định.
4. Điện tích toàn phần ở pH trung tính: Ở pH sinh lý thì các amino acids sẽ có một nhóm tích điện âm (-COO–) và một nhóm tích điện dương (-NH3+), cả hai nhóm đều liên kết vào một alpha-carbon. Glutamate, aspartate, histidine, arginine và lysine có thêm các nhóm tích điện mạnh ở trong chuỗi bên của chúng. Các chất như amino acids có thể đóng vai trò như là một acid hay một base thì được gọi là lưỡng tính.
C. Hệ đệm trong máu – Hệ đệm bicarrbonate
pH trong máu của chúng ta được duy trì ở mức hơi kiềm, thay đổi từ 7.35 đến 7.45 bởi hệ thống đệm bicarbonate. Hầu hết các proteins thực hiện được chức năng tối ưu ở mức pH sinh lý này; các ngoại lệ sẽ bao gồm các enzymes tiêu hóa thực hiện chức năng ở pH acid của dạ dày khoảng từ 1.5 đến 3.5. Các enzymes lysosome cũng thực hiện chức năng ở pH acid thay đổi từ pH 4.5 đến 5.0. Duy trì pH máu động mạch ở mức 7.40 +- 0.5 có vai trò to lớn đối với sức khỏe của chúng ta; bình thường thì hệ đệm bicarbonate có khả năng giữ pH bên trong một khoảng có thể chấp nhận được.
Nồng độ ion bicarbonate, [HCO3–] và nồng độ carbon dioxide [CO2] sẽ tác động đến pH của máu như thể hiện ở Hình 12A. Sự cần thiết của một hệ thống đệm có thể quan trọng đối với các acid hữu cơ (như lactic acid) được tạo ra trong suốt quá trình chuyển hóa và sự oxy hóa glucose và acid béo sẽ tạo ra CO2, là dạng khan (không có nước) của H2CO3 (carbonic acid). CO2 thì tương đối tan trong nước và được chuyển bởi enzyme carbonic anhydrase thành bicarbonate (HCO3–) có thể tan trong nước, được vận chuyển bởi máu đến phổi, nơi mà CO2 tự do được thở ra ngoài. Vì thế, phổi giúp điều hòa sự mất và sự giữ CO2 bằng cách thay đổi nhịp thở. Thận cũng quan trọng trong điều hòa thăng bằng acid-base. Thận giữ hoặc bài tiết bicarbonate, H+, ammonia và các acids/bases khác có thể xuất hiện trong máu.
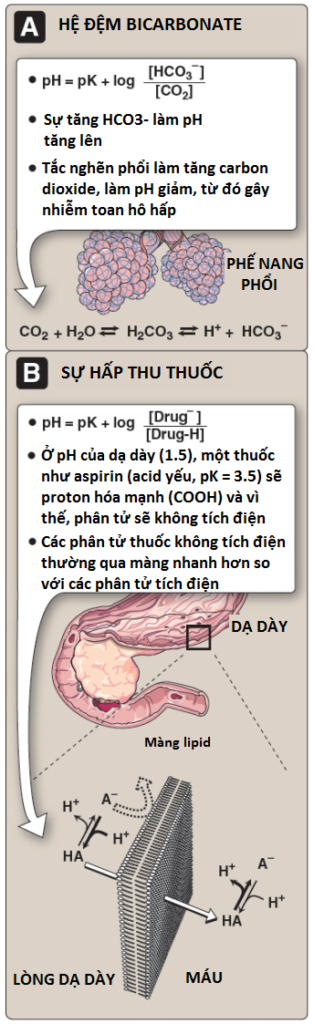
D. pH và sự hấp thu thuốc
Nhiều thuốc được dùng đường uống và phải được vận chuyển qua các tế bào biểu mô ruột để được hấp thu vào trong máu. Hầu hết các thuốc là acid yếu hoặc base yếu. Các thuốc acid (HA) sẽ giải phóng một H+ và tạo ra một anion tích điện (A–). Các bases yếu (BH+) cũng có thể giải phóng một H+; tuy nhiên, dạng proton hóa của các thuốc base thì thường được tích điện và sự mất một proton sẽ tạo ra base không tích điện (B).
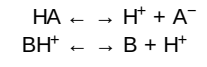
Các thuốc được hấp thu tốt nhất ở một pH mà sự phân ly của các chuỗi bên của chúng sẽ tạo ra phân tử trung hòa nhất. Nồng độ hiệu quả của dạng có thể thấm của mỗi thuốc ở vùng hấp thu được xác định bởi các nồng độ tương đối của các dạng tích điện và không tích điện. (Hình 12B). Người ta cho rằng sự vận chuyển các thuốc xảy ra thông qua các proteins vận chuyển và thường xảy ra nhờ sự vận chuyển tích cực mặc dù các hệ thống này thì không được chỉ rõ đặc điểm.
E. Khí máu và pH
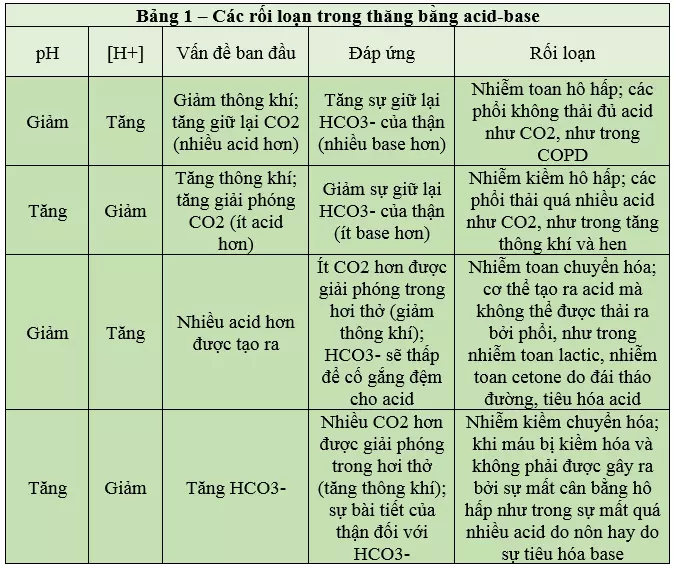
Như là kết quả của các tiến trình bệnh tật hay ngộ độc nhất định, pH máu có thể trở nên bất thường. Nhiễm toan máu được định nghĩa là khi pH máu động mạch dưới 7.35 và nhiễm kiềm máu được định nghĩa là khi pH máu động mạch trên 7.45. Trong hệ thống đệm bicarbonate, CO2 là một acid và bicarbonate là một base. Bởi vì hệ đệm bicarbonate là một hệ thống mở và CO2 được giải phóng ra trong hơi thở nên các thay đổi trong quá trình thở có thể làm ảnh hưởng đến thăng bằng acid-base trong cơ thể. Tăng thông khí có thể làm giải phóng quá nhiều acid, gây ra nhiễm kiềm; mặc khác, sự tạo ra quá nhiều acids trong chuyển hóa (như nhiễm toan lactic hay nhiễm toan cetone (có thể kèm theo đái tháo đường type 1)) có thể gây ra tình trạng nhiễm toan. Sự mất quá nhiều acid qua nôn có thể dẫn đến rối loạn thăng bằng acid-base. Cả sự đền bù của thận và sự đền bù bởi thay đổi nhịp thở (đền bù hô hấp) cũng không thể mang pH trở về mức sinh lý bình thường nếu như lượng acids chuyển hóa tạo ra quá nhiều. Các bạn nên chú ý rằng cả phổi và thận đều không thể bù hoàn toàn hay quá bù đối với sự mất thăng bằng pH. Đo CO2 và bicarbonate cùng với pH có thể giúp xác định sự mất thăng bằng acid-base xuất hiện trên bệnh nhân (Bảng 1).
IV. Tổng hợp bài viết
- Mỗi amino acid có một nhóm alpha-carboxyl và một nhóm alpha-amino bậc 1 (trừ proline, có một nhóm amino bậc 2).
- Bởi vì alpha-carbon của mỗi amino acid (trừ glycine) được gắn với 4 nhóm hóa học khác nhau cho nên nó là một nguyên tử carbon bất đối và các amino acids sẽ tồn tại ở các dạng đồng phân D- và L-, là các đồng phân đối quang, hoạt động về mặt quang học. Dạng L- của amino acids được tìm thấy trong các proteins tổng hợp bởi cơ thể người.
- Ở pH sinh lý, nhóm alpha-carboxyl phân ly để hình thành nên ion carboxylate (-COO-) tích điện âm và nhóm alpha-amino được proton hóa (-NH3+).
- Mỗi amino acid cũng sẽ chứa một trong 20 chuỗi bên (nhóm R) khác nhau, liên kết với nguyên tử carbon alpha.
- Bản chất hóa học của nhóm R này sẽ giúp xác định chức năng của một amino acid trong một protein và cung cấp nền tảng cho việc phân loại các amino acids như không phân cực, phân cực không tích điện, có tính acid (phân cực âm) hay có tính base (phân cực dương).
- Tất cả các amino acids tự do cùng với các amino acids tích điện trong các chuỗi peptide có thể đóng vai trò như các hệ đệm.
- Mối liên hệ về lượng giữa pH dung dịch, nồng độ của một acid yếu (HA) cùng và base liên hợp của nó (A-) được mô tả bởi phương trình Henderson-Hasselbalch. Quá trình đệm sẽ xảy ra trong khoảng +-1 đơn vị của pKa và đạt khả năng đệm đạt tối đa khi pH = pKa, ở đó [A-] = [HA].
- pH bên trong máu được duy trì ở khoảng hơi kiềm là 7.4 +- 0.5 bởi hệ thống đệm bicarbonate; các phổi điều hòa acid CO2 bằng cách thay đổi tần số thở và thận giữ hoặc giải phóng các acids và các bases.
Các bạn có thể xem bài viết mới trên Facebook tại đây: https://www.facebook.com/profile.php?id=61550892771585
Các bạn có thể xem bài viết tiếp theo tại đây: https://docsachxyz.com/cau-truc-cua-cac-phan-tu-proteins/
Cảm ơn các bạn đã theo dõi bài viết. Hẹn gặp lại các bạn trong các bài viết tiếp theo nhé !!!